Согласно современным представлениям все вещества, находящиеся в жидком или парообразном состоянии, состоят из молекул. В твердом состоянии только органические вещества имеют молекулярную структуру, а также некоторые неметаллы, оксиды углерода и вода. Большинство же твердых неорганических веществ не имеют молекулярной структуры: их строение определяется решеткой, состоящей из атомов и ионов, образующих макротела – кристаллы. Молекулярной структуры не имеют соли, оксиды металлов, кремний, алмаз, металлы и т. д.
- Строение атома, периодическая таблица элементов
- Масса атома
- Закон Авогадро
- Основы химии газов
- Классификация углеводородов
- Алканы
- Алкены
- Алкадиены
- Алкины
- Циклоалканы
- Ароматические углеводороды
- Ненасыщенные углеродные связи
- Полимеризация
- Димеризация
- Перекиси
- Ингибиторы
- Пахучие вещества
- Неорганические газы
- Реакция углеводородов с водой – образование гидратов (Slush)
- Химическая совместимость газов
Химические связи между молекулами менее прочные, чем между атомами, и поэтому температуры плавления и кипения веществ с молекулярной структурой сравнительно низкие. Современная химия изучает свойства микрочастиц (молекул, атомов, ионов) и макротел.
Строение атома, периодическая таблица элементов
Из школьного курса физики известно, что вокруг положительно заряженного ядра атома движутся электроны, имеющие единичный отрицательный заряд. Так как в целом атом электрически нейтрален, то, следовательно, число электронов, движущихся вокруг ядра атома, должно быть равно заряду ядра атома.
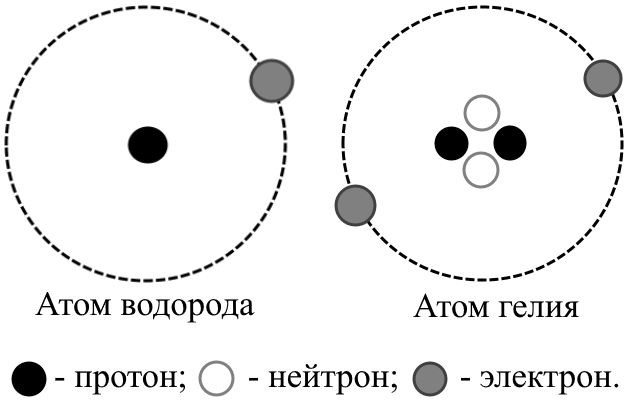
Ядро атома состоит из протонов (частицы с массой 1 и зарядом +1). Поскольку масса атомов, кроме атома водорода, всегда больше той массы, которая приходится на долю протонов, то было естественно предположить, что в состав ядра входят и электрически нейтральные частицы с массой 1, которые были названы нейтронами.
Было установлено, что свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядра атомов этих элементов.
В периодической таблице элементов порядковый номер элемента совпадает с зарядом ядра его атома.
Электроны в атомах обладают различным запасом энергии и в зависимости от величины этой энергии электроны располагаются на различных энергетических уровнях или орбитах относительно ядра атома.
Количество электронов на внешнем энергетическом уровне определяет валентность элемента (его химическую активность), поэтому они называются валентными электронами.
В периодической таблице ( рис. 1) все элементы сгруппированы по группам и периодам. Вертикальные колонки таблицы элементов называются группами, и элементы, расположенные в одних и тех же группах, имеют одинаковое количество электронов на внешней орбите (электронов определяющих валентность элемента). Всего в таблице 8 основных групп элементов.

Периодическая таблица имеет также 7 горизонтальных строк (периодов), поскольку каждый атом не может иметь более 7 электронных орбит. Можно сказать, что количество электронных орбит определяет энергетический уровень электронов.
Когда два или более атомов объединяются между собой, образуется молекула вещества.
Если два атома имеют одну или несколько пар электронов, являющихся общими для этих атомов, т. е. электроны перескакивают с орбиты одного атома на орбиту другого, возникает так называемая ковалентная связь. Основную часть неорганических элементов составляют металлы, они формируют металлические связи между атомами. При атом атомы располагаются очень близко друг к другу и образуют структурную (кристаллическую) решетку. В правой части периодической таблицы элементов расположены инертные газы и существуют они только в виде атомов.
Масса атома
Одной из основных характеристик любого химического элемента является его относительная атомная масса. Атомная единица массы – это 1/12 массы атома углерода, масса которого принимается равным 12 а. е. м., и составляет 1,66 · 10-24 г. Сравнивая массы атомов элементов с одной а. е. м., находят численные значения относительной атомной массы (Ar). Относительная атомная масса элемента показывает во сколько раз масса его атома больше 1/12 массы атома углерода.
Например, для кислорода Ar (O) = 15,9994, а для водорода Ar (H) = 1,0079.
Для молекул простых и сложных веществ определяют относительную молекулярную массу, которая численно равна сумме атомных масс всех атомов, входящих в состав молекулы. Например, молекулярная масса воды H2O равна:
Закон Авогадро
В химии, наряду с единицами массы и объёма, пользуются единицей количества вещества, называемой молем.
Это означает, что 1 моль любого вещества содержит одно и тоже число структурных единиц, равное 6,02 · 1023. Эта величина носит название постоянной Авогадро (обозначение NA, размерность 1/моль).
Итальянский ученый Амадео Авогадро в 1811 году выдвинул гипотезу, которая в дальнейшем была подтверждена опытными данными и получила впоследствии название закон Авогадро. Он обратил внимание на то, что все газы одинаково сжимаются (закон Бойля-Мариотта) и обладают одинаковыми коэффициентами термального расширения (закон Гей-Люссака), и высказал мысль, что:
В равных объёмах различных газов, находящихся при одинаковых условиях, содержится одинаковое число молекул.
При одинаковых условиях (обычно говорят о нормальных условиях: абсолютное давление равно 1 013 миллибар и температура 0 °С) расстояние между молекулами у всех газов одинаково, а объём молекул ничтожно мал. Учитывая все вышесказанное, можно сделать предположение, что:
Другими словами:
1.
Точное значение молярного объёма газа при нормальных условиях (давление 1 013 миллибар и температура 0 °С) составляет 22,4135 ± 0,0006 л/моль. При стандартных условиях ( t = +15 °С давление = 1 013 мбар) 1 моль газа занимает объём 23,6451 литра, а при t = +20 °С и давлении 1 013 мбар 1 моль занимает объём около 24,2 литра.
2.
Например, M(O2) = 16 а. е. м. · 2 = 32 а. е. м., таким образом, 1 моль кислорода соответствует 32 граммам.
Плотности газов, измеренные при одинаковых условиях, относятся как их молярные массы.
Так как при Свойства сжиженных газов, перевозимых на судах-газовозахперевозке сжиженных газов на газовозах, основным объектом практических задач являются молекулярные вещества (жидкости, пары, газы), то и основными искомыми величинами будут молярная масса M в г/моль, количество вещества ν в молях и масса (m) вещества в граммах или килограммах.
Зная химическую формулу того или иного газа, можно решить некоторые практические задачи, возникающие при транспортировке сжиженных газов.
Пример 1
В дек-танке находится 22 тонны сжиженного этилена (С2Н4). Необходимо определить, достаточно ли на борту груза для того, чтобы продуть три грузовых танка объёмом 5 000 м³ каждый, если после продувки температура танков будет составлять 0 °С, а давление 1 013 миллибар.
Решение:
1. Определяем молекулярную массу этилена
2. Рассчитываем плотность паров этилена при нормальных условиях:
3. Находим объём паров груза при нормальных условиях:
Общий объём грузовых танков составляет 15 000 м³. Следовательно, на борту достаточно груза на борту для того, чтобы продуть все грузовые танки парами этилена.
Пример 2
Необходимо определить какое, количество пропана (С3Н8) потребуется для продувки грузовых танков общей вместимостью 8 000 м³, если температура танков составляет +15 °С, а давление паров пропана в танке после окончания продувки не будет превышать 1 013 миллибар.
Решение:
1. Определим молярную массу пропана С3Н8
2. Определим плотность паров пропана после продувки танков:
3. Зная плотность паров и объём определяем общее количество пропана, необходимое для продувки танка:
Основы химии газов
И природный газ, и нефтяные газы представляют собой сложные смеси органических и неорганических соединений. Промышленные же газы получают путем переработки вышеупомянутых газов. Однако в основе всех промышленных газов лежат углеводороды, которые в соединении с галогенами (фтор, хлор, бром, йод), кислородом, азотом и др. дают весь спектр промышленных газов.
Органическая химия – это наука, изучающая соединения углерода.
Сырая нефть, например, представляет собой смесь огромного числа углеводородов. Простейшая форма углеводородов – это метан, состоящий из одного атома углерода и 4-х атомов водорода:
Во всех органических соединениях атом углерода является четырехвалентным. Общая формула углеводородов
где:
- m и n – целые числа.
Классификация углеводородов
В настоящее время насчитывается около 5 миллионов органических соединений и, тем не менее, ежегодно открывается или синтезируется примерно 200 тысяч новых органических соединений. И каждое соединение должно быть названо таким образом, чтобы в его названии отражалось строение вещества.
Поэтому, уже в 1892 году в Женеве на Международном Конгрессе были заложены основы номенклатуры органических соединений. Сейчас действуют Правила Международного Союза Чистой и Прикладной Химии (UIPAC). Существование Правил дает возможность составлять специализированные коды перевозимых газов, которыми пользуются в настоящее время все перевозчики.
Ряд сходных по строению органических соединений, обладающих близкими химическими свойствами, в которых отдельные члены ряда отличаются друг от друга лишь количеством в них групп –СН2– называются гомологическим рядом. Свойства органического соединения в основном определяются составом его функциональной группы (наиболее легко изменяющейся и вступающей в реакции частью молекулы). Это и дает возможность классифицировать органические соединения по гомологическим рядам или же классам органических соединений. Для любого гомологического ряда может быть выведена формула, отображающая соотношение атомов углерода и водорода у членов этого ряда.
Для того чтобы легче разобраться с разновидностями углеводородов, рассмотрим классы углеводородов в зависимости от сложности их состава. Такими классами (гомологическими рядами) являются:
- Алканы (парафины) – ряд метана;
- Алкены (олефины) – ряд этилена;
- Алкадиены (диеновые углеводороды);
- Алкины – ряд ацетилена;
- Циклоалканы (циклопарафины);
- Ароматические углеводороды ряда бензола (арены).
Алканы
Предельные углеводороды ряда метана. Все названия предельных углеводородов оканчиваются суффиксом – ан. Простейшими представителями таких органических соединений являются:
- Метан,
- Этан,
- Пропан,
- Бутан,
- Изо-бутан.
С увеличением числа атомов углерода в молекуле, значительно меняется плотность вещества и его свойства. Если, например, молекулы, содержащие от 1 до 4 атомов углерода, являются газами, то вещества, молекулы которых содержат от 5 до 17 атомов углерода – уже жидкости, а молекулы, в которых содержание углерода более 17 атомов, представляют собой твердые вещества. Начиная с молекул углеводородов, в которых содержится 4 и более атомов углерода, начинает меняться пространственная структура молекул, т. е. взаимное расположение атомов углерода. При этом изменяются все свойства веществ.
Если бутан, состоящий из 4-х атомов углерода и 10 атомов водорода, имеет 2 изомера, то октан, состоящий из 8 атомов углерода и 18 атомов водорода имеет уже 18 изомеров. Изомеры отличаются друг от друга температурой кипения, плавления, температурой воспламенения, вязкостью и пр., т. е. физическими свойствами.
Отличительная особенность алканов – это то, что все четыре валентных связи углерода являются одинарными, что вызывает инертность таких углеводородов в обычных условиях.
Общую химическую формулу алканов можно выразить следующим образом:
где:
- n – целое число.
Алканы не взаимодействуют между собой и не растворяются в воде. При высокой температуре и под действием ультрафиолетового излучения алканы вступают в реакцию с хлором и бромом с образованием галогенных углеводородов.
Хлоропроизводные метана широко используются в промышленности. Хлорметан – газ, который легко сжижается и, при последующем испарении, поглощает значительное количество теплоты. Этот газ получил широкое использование в холодильных установках.
Алкены
Следующей важной группой углеводородов, которые не встречаются в природе в свободном состоянии, но могут быть получены из нефти в процессе крекинга, являются алкены. Все названия непредельных углеводородов ряда этилена оканчиваются суффиксом – ен.
Общая формула алкенов
где:
- n – целое число.
Простейшим из алкенов является этилен (этен):
Двойная связь между атомами углерода не является прочной, поэтому алкены химически более активны, чем алканы.
Как и алканы, алкены образуют целый ряд изомеров, причем такие изомеры отличаются как структурой молекулы, так и расположением двойной связи между атомами углерода, а также пространственным расположением атомов элементов. Из-за наличия двойных связей алкены могут присоединять еще один атом водорода и, поэтому они могут вступать в реакцию с алканами.
Алкадиены
Названия диеновых углеводородов образуются от соответствующих названий предельных углеводородов с суффиксом – диен.
Общая формула диеновых углеводородов:
Также как и все остальные углеводороды алкадиены образуют изомеры, начиная с 5-го атома углерода. Изомеры, образующиеся при этом, также различаются по скелетному расположению атомов углерода, по расположению двойных связей и по ориентации элементов молекулы в пространстве.
Простейшим представителем диеновых углеводородов является бутадиен:
- C4H6
Большинство алкадиенов используется как сырье для получения синтетических пластмасс. В частности бутадиен используется для получения синтетического каучука.
Алкины
Все названия непредельных углеводородов ряда ацетилена оканчиваются суффиксом – ин. Общая формула для алкинов:
то есть точно такая же, как и для алкадиенов. Простейшими представителями этой группы являются:
- Ацетилен (Этин) CH ≡ CH
- и пропин CH3 – C≡ CH
Характерными реакциями являются реакции присоединения, окисления и полимеризации. При взаимодействии ацетилена с соляной кислотой (HCl) образуется винил хлорид мономер (VCM), который может полимеризовываться в поливинил хлорид. Данный продукт широко используется для получения пластмасс.
Винил хлорид (хлорвинил, хлорэтилен)
Винил хлорид используется при изготовлении диэлектрических пластмасс, искусственной кожи и т. д.
Циклоалканы
Некоторые молекулы предельных углеводородов могут соединяться таким образом, что каждый из атомов углерода в молекуле будет иметь по две свободных валентных связи. В таком случае молекулы углеводородов будут иметь цикличную (замкнутую форму).
Названия циклопарафинов образуются от соответствующих названий предельных углеводородов с добавлением префикса цикло-. Простейшие представители циклопарафинов – циклопропан и циклобутан, однако наиболее часто встречаются циклопарафины более высокого порядка, например, циклопентан или циклогексан. Общая химическая формула циклоалканов выглядит следующим образом:
Структурное строение молекулы можно представить на примере циклопропана:
В подавляющем большинстве циклопарафины нашли применение как растворители в химической промышленности и в медицине. Наиболее часто используются галогенопроизводные циклопарафинов.
Ароматические углеводороды
Когда молекула углеводорода содержит более 3 атомов углерода, они могут объединяться, образовывая соединения в форме кольца – бензольное кольцо. Углеводороды, молекулы которых содержат бензольные кольца, называются цикличными или ароматическими углеводородами. Общая формула для этих углеводородов:
Простейшие представители этой группы:
- C6H6 – бензол;
- C6H5 – CH3 – толуол.
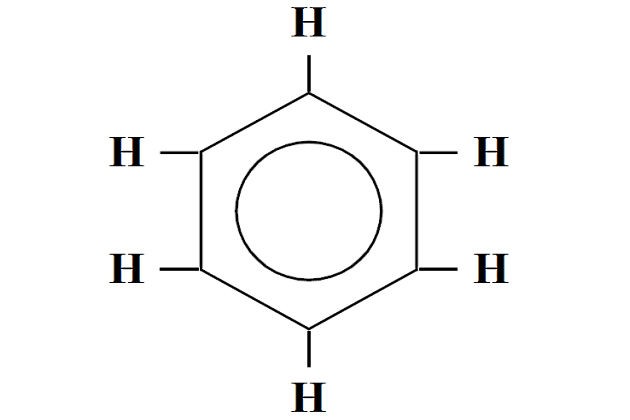
Изомерия в ряду бензола обусловлена взаимным расположением органических радикалов в ядре (метильной группы CH3). При этом образуются 3 изомера расположение заместителей в которых указывается приставками орто-, мета-, и пара-. Шесть атомов углерода образуют правильный шестиугольник. Бензольные кольца обычно очень устойчивы и являются составной частью больших молекул. Характерными реакциями для аренов является реакция замещения.
Ненасыщенные углеродные связи
Связи между атомами углерода содержащие более одной валентной связи, называются ненасыщенными.
Характерной особенностью таких связей является то, что атомы используют незадействованную связь для присоединения дополнительных атомов с высокой активностью, например, галогенов. При этом образуется абсолютно новое вещество. Галогенизированные углеводороды используются в химической промышленности в качестве различного рода отвердителей или охлаждающих агентов.
Полимеризация
Особое свойство ненасыщенных углеводородов – это реакция полимеризации, которая может протекать при определенных температуре и давлении.
Реакция полимеризации может протекать только при определенных условиях: наличии необходимой температуры и давлении. Обычно для ускорения реакции используются катализаторы, которые увеличивают скорость протекания реакции, однако сами в ней химически не участвуют.
| Процесс полимеризации | ||
|---|---|---|
| Мономер | Полимер | |
| Винил хлорид | (CH2 = CHCl) | -(CH2 – CHCl)n- |
| Пропилен | (CH3CH = CH2) | -(CHCH3 – CH2)n- |
| Стирол | (CH2 = C6H) | –(CHC6H5 – CH2)n- |
Во время полимеризации протекает цепная реакция, вовлекающая в процесс все большее и большее количество молекул, до тех пор, пока вся жидкость не превратиться в твердый полимер.
Димеризация
Димеризация – это начальная стадия полимеризации, при которой только две молекулы непредельных углеводородов соединяются между собой. Однако из-за внешних условий (давления и температуры) дальнейшее соединение молекул между собой не происходит. Однако, в большинстве случаев при соединении двух одинаковых молекул углеводородов, образуется новое вещество, которое делает груз непригодным для его дальнейшего использования. Наиболее часто реакция димеризации происходит при транспортировке 1,3-бутадиена (цифрами обозначаются атомы углерода, после которых располагается двойная связь). В результате реакции образуется новое вещество – винил циклогексан.
Наличие в грузе димеров строго лимитировано. Например, в бутадиене концентрация димеров не должна превышать 50 ррм (Part per million). Содержание димеров в бутадиене имеет линейную зависимость от температуры.
Перекиси
Одним из простейших катализаторов, который используется в химической индустрии при производстве пластмасс, являются перекиси различных элементов. Отличительная особенность перекисей в том, что они содержат в молекуле два атома кислорода, соединенные между собой. Наличие такой связи обеспечивает их легкий переход в химические радикалы, что и вызывает реакцию полимеризации. Примерами перекисей может служить:
- перекись водорода – H – O – O – H
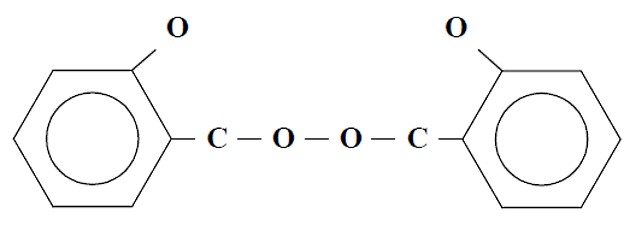
Все перекиси являются чрезвычайно взрывоопасными и требуют при обращении особой осторожности. Перекиси могут покрывать тонким слоем стенки трубопроводов, переборки танков и контейнеров. Эти вещества чрезвычайно нестабильны и любое внешнее воздействие (солнечный свет, удар и пр.) на них может привести к взрыву, особенно если они находятся в достаточном количестве и под действием высокой температуры. В таком случае, даже незначительное трение может привести к взрыву.
Некоторые ненасыщенные углеводороды, соединяясь с кислородом воздуха, могут также образовывать перекиси, что может вызвать спонтанную реакцию полимеризации. Для предотвращения объединения молекул перекисей с ненасыщенными углеводородами, необходимо, чтобы содержание кислорода в танке и трубопроводах было очень низким.
Вот почему при перевозке некоторых грузов, например бутадиена или винилхлорида, содержание кислорода в танках не должно превышать 0,2-0,3 %.
Ингибиторы
Для того чтобы избавить атмосферу танка от последних следов кислорода, используют специальные вещества, которые, находясь в грузе даже в малых концентрациях, вступают в реакцию со свободным кислородом, снижая его содержание в атмосфере танка. Еще одно их свойство – они вступают в реакцию с химическими радикалами, замедляя реакцию полимеризации.
Вещества, замедляющие или приостанавливающие химическую реакцию, называются ингибиторами.
При транспортировке морем 1,3-бутадиена из портов США, Береговая Охрана США требует добавления в груз 100 ррм ТВС (тетра бутил катекола). Это делается для того, чтобы избежать полимеризации груза (обычно реакция полимеризации протекает с выделением большого количества тепла). При перевозке винилхлорида в груз добавляют гидрохинон для предотвращения образования полимеров.
Большинство ингибиторов являются чрезвычайно ядовитыми веществами и поэтому обращаться с ними надо с величайшей осторожностью.
Пахучие вещества
По-английски такие вещества называются Stench agent или Odorizer и служат для придания специфического запаха газам, не имеющим его.
Поскольку некоторые газы являются высоко опасными в пожарном отношении, даже их малая протечка должна быть остановлена так скоро, как это только возможно. Однако многие газы, такие как нефтяные, вообще не имеют запаха. Поэтому для того, чтобы можно было почувствовать утечку газа, даже в незначительной концентрации в них добавляют небольшое количество веществ (буквально несколько граммов на тонну груза), имеющих очень сильный запах (таких как меркаптан).
Неорганические газы
Из неорганических газообразных соединений на газовозах обычно перевозятся аммиак и хлор.
Аммиак NH3 – бесцветный газ с сильным раздражающим запахом. Вступает в реакцию с углекислым газом CO2 с образованием твердого карбоната аммиака, скопления которого в трубопроводах могут вывести из строя грузовое оборудование. Поэтому при Подготовка грузовых танков газовозовинертизации танков для перевозки аммиака используется только азот. Аммиак хорошо растворим в воде.
Хлор – галоген с зеленоватым цветом и характерным удушливым запахом. Хлор легко сжижается, ядовит, в 2,5 раза тяжелее воздуха, химически активен. Вот почему перевозка хлора является предметом особого рассмотрения ИМО и требует особых условий и строгих мер предосторожности.
Реакция углеводородов с водой – образование гидратов (Slush)
Практически все углеводороды в паровой фазе содержат в своем составе молекулы воды. Более того, вода в небольшом количестве может присутствовать в жидкой фазе газов. Причем с понижением температуры, содержание воды в газах уменьшается. Существует лишь ограниченная информация и о том, что вода может присутствовать в сжиженных газах и при минусовых температурах.
Из-за того, что в молекуле воды атомы водорода смещены относительно оси молекулы и расположены примерно под углом 104° друг к другу, молекула воды имеет биполярную структуру. В жидком состоянии каждая молекула воды связана с 4-мя соседними молекулами водородными связями, образующими тетраэдр, из которых построена трехмерная сетка, имеющая полости в виде многогранников.
Читайте также: Аварийная грузовая система газовоза, типы пожарных систем
Несколько молекул воды, связанных с углеводородами, при этом образуют твердые кристаллические вещества (гидраты) в виде мелкого снега или рыхлого льда. Гидраты могут формироваться в таких грузах как метан, этан, пропан, бутан и этилен. Для всех перечисленных углеводородов характерно одно необычное свойство – в газовой фазе в них растворяется гораздо больше воды, чем в жидкой. Например, пропан при температуре +6 °С может содержать в жидкой фазе до 40 ррм растворенной воды, а в газовой фазе при той же температуре уже 580 ррм. Для того чтобы началось формирование гидратов, углеводороды должны содержать в своем составе свободную воду, т. е. количество воды должно превышать количество, необходимое для насыщения углеводородов водой.
Формирование гидратов – процесс продолжительный и непрерывный, т. е. количество кристаллов гидратов будут расти, если условия их образования сохранятся. Гидраты могут формироваться и в жидкой и в газовой фазе. Так, например, при конденсации паров пропана в грузовом конденсаторе установки реконденсации, свободная вода, выделившаяся из паров груза в процессе конденсирования, может послужить причиной образования гидратов в процессе охлаждения конденсата после редукционного клапана или же на распыле грузового танка.
Для пропана и бутана, формирование гидратов может происходить при условиях, представленных в таблицах:
| Таблица 1. Условия образования гидратов в пропане | |
|---|---|
| Давление в барах | Температура (°С) |
| 0 | -2 |
| 0,7 | 0 |
| 2,7 | +3 |
| 4,1 | +5 |
| 5,2 | +6 |
| Таблица 2. Критическое содержание воды в пропане, достаточное для образования гидратов при температурах ниже +6 °С | ||
|---|---|---|
| Содержание воды (ррм) | Температура груза (°С) | |
| В жидкой фазе | В газовой фазе | |
| 1 | 37 | -45 |
| 1,4 | 50 | -40 |
| 4 | 110 | -30 |
| 6,5 | 150 | -25 |
| 10 | 220 | -20 |
| 16 | 284 | -15 |
| 24 | 420 | -10 |
| 30 | 500 | -7,5 |
| 36 | 580 | -5 |
| 52 | 780 | 0 |
| Таблица 3. Критическое содержание воды в бутане, достаточное для образования гидратов при температурах ниже +3 °С | ||
|---|---|---|
| Содержание воды в бутане (ррм) | Температура груза °С | |
| В жидкой фазе | В газовой фазе | |
| 9 | 1.000 | -10 |
| 13 | 1.300 | -5 |
| 17 | 1.600 | 0 |
| Таблица 4. Минимальные концентрации метанола, необходимые для нейтрализации свободной воды в пропане, в диапазоне насыщения | |||
|---|---|---|---|
| Минимальная концентрация метанола в миллионных частях по массе | Температура груза (°С) | ||
| В жидкой фазе | В газовой фазе | Всего | |
| 540 | 36 | 576 | -45 |
| 658 | 43 | 701 | -40 |
| 966 | 70 | 1.036 | -30 |
| 1.122 | 81 | 1.203 | -25 |
| 1.265 | 93 | 1.328 | -20 |
| 1.373 | 98 | 1.471 | -15 |
| 1.564 | 115 | 1.679 | -10 |
| 1.587 | 119 | 1.706 | -7,5 |
| 1.436 | 107 | 1.543 | -5 |
| 1.134 | 83 | 1.217 | 0 |
| Таблица 5. Минимальная концентрация метанола для нейтрализации свободной воды в бутане в диапазоне насыщения | |||
|---|---|---|---|
| Концентрация метанола в миллионных частях по весу | Температура (°С) | ||
| Жидкая фаза | Газовая фаза | Всего | |
| 488 | 218 | 705 | -10 |
| 412 | 172 | 584 | -5 |
| 229 | 87 | 316 | 0 |
Для того чтобы предотвратить образование гидратов, поскольку они могут заблокировать и регулировочный клапан, и сопла распыла, и грузовые насосы, на газовозах используется этиловый или метиловый спирт, который связывает свободную воду и не позволяет ей соединяться с молекулами углеводородов.
Химическая совместимость газов
В приведенных ниже таблицах даны обобщенные химические свойства некоторых газов и их химическая совместимость с различными материалами.
| Таблица 6. Основные опасности и химическая совместимость некоторых газов | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Метан | Этан | Пропан | Бутан | Этилен | Пропилен | Бутилен | Бутадиен | Изопрен | Аммиак | Винил хлорид | Этилен оксид | Пропилен оксид | Хлор | Водяной пар | Кислород воздуха | Углекислый газ | |
| Пожароопасность | Х | X | X | X | X | X | X | X | X | X | X | X | X | ||||
| Токсичность | X | X | X | X | X | X | X | ||||||||||
| Полимеризация | X | X | X | X | |||||||||||||
| СОВМЕСТИМОСТЬ | |||||||||||||||||
| Магний | X | X | X | X | |||||||||||||
| Ртуть | X | X | X | X | X | X | |||||||||||
| Цинк | X | X | |||||||||||||||
| Медь | X | X | X | X | X | ||||||||||||
| Алюминий | X | X | X | X | X | X | X | ||||||||||
| Углеродистая сталь | X | X1 | |||||||||||||||
| Нержавеющая сталь | X2 | ||||||||||||||||
| Железо | X | X | |||||||||||||||
| Политетрафторэтилен | X3 | X | X | X | X | X | |||||||||||
| Полихлорвинил | X | ||||||||||||||||
| Полиэтилен | |||||||||||||||||
| Этанол | X | ||||||||||||||||
| Метанол | X | ||||||||||||||||
| Метан | X | ||||||||||||||||
| Этан | X | ||||||||||||||||
| Пропан | X | ||||||||||||||||
| Бутан | X | ||||||||||||||||
| Этилен | X | ||||||||||||||||
| Пропилен | X | ||||||||||||||||
| Бутилен | X | ||||||||||||||||
| Бутадиен | X | X | X | ||||||||||||||
| Изопрен | X | X | X | ||||||||||||||
| Аммиак | X | X | X | X | |||||||||||||
| Винил хлорид | X | X | |||||||||||||||
| Этилен оксид | X | X | |||||||||||||||
| Пропилен оксид | X | ||||||||||||||||
| Хлор | X | X | X | X | X | X | X | X | X | X | X | X | |||||
| Водяной пар | X | X | X | ||||||||||||||
| Кислород воздуха | X | X | X | X | |||||||||||||
| Углекислый газ | X | ||||||||||||||||
- X1 – для перевозки этилена обычно используется сталь с содержанием никеля не менее 9 %;
- X2 – следует проверить совместимость по “ИМО Кодексу”;
- X3 – не выдерживает воздействия низких температур.
- Политетрафтороэтилен (PTFE) – уплотнительный материал;
- Поливинилхлорид – (PVC) – материал для изоляции электрокабелей.
