Способность горючего сохранять первоначальные свойства в условиях хранения, транспортировки и применения называется стабильностью. Надежность и эффективность работы любого двигателя обеспечивается применением горючего с необходимым уровнем эксплуатационных свойств. При недостаточной стабильности качество горючего к моменту применения не будет соответствовать необходимым требованиям и могут возникнуть серьезные неполадки и отказы в работе двигателя.
Эксплуатационные и капитальные затраты, связанные с организацией хранения, транспортировки и применения горючего, тем больше, чем меньше его стабильность. Со стабильностью горючего тесно связано другое важное свойство – склонность к отложениям и загрязнению, так как некоторые стадии образования отложений и осадков включают физико-химические превращения, характерные для процессов изменения свойств горючего.
Свойства горючего изменяются в результате физических и химических процессов. Наиболее важными процессами для физической стабильности являются фазовые переходы:
- кристаллизация,
- застывание,
- испарение и поглощение влаги,
а для химической стабильности:
- окисление,
- разложение,
- конденсация,
- полимеризация и взаимодействие с конструкционными и различными эксплуатационными материалами (последние процессы имеют чаще всего физико-химическую природу).
Физические превращения — кристаллизация и загустевание, а также поглощение влаги были рассмотрены в статье о Прокачиваемость горючего в дизельных двигателяхпрокачиваемости горючего.
Необходимо отметить тесную взаимную связь физических и химических превращений. В горючем сложного состава в большинстве случаев протекают необратимые процессы с изменением качества. Например, кристаллизация, загустевание и поглощение влаги в присутствии частиц загрязнений и некоторых гетероорганических соединений, растворенных в топливе, сопровождаются образованием таких конгломератов и твердых частиц, которые не возвращаются в первоначальное состояние при изменении внешних условий, а активно участвуют в дальнейших физико-химических превращениях с образованием осадков и отложений.
В результате химических превращений возможны весьма значительные изменения состава горючего. Наиболее существенное значение для применения углеводородного горючего имеют процессы образования смолистых, кислых веществ и осадков различного вида. Некоторое количество смолистых веществ и гетероорганических соединений, способствующих образованию осадков, имеется в любом горючем. В процессе окислительных превращений одновременно со смолами и осадками всегда образуются кислоты, часть из которых агрессивна.
Химические превращения при окислении углеводородного горючего
В сложном комплексе окислительных превращений углеводородного горючего основной является реакция окисления молекулярным кислородом. Процесс окисления углеводородов развивается по цепному механизму, в ходе которого образуются различные промежуточные и конечные кислородсодержащие продукты:
- органические перекиси,
- спирты,
- карбонильные соединения,
- эфиры,
- органические кислоты,
- а также бифункциональные соединения.
В сложном механизме жидкофазного окисления углеводородов можно выделить следующие основные стадии:
- зарождение цепей и образование радикалов R—;
- продолжение цепи в реакциях радикала R— с кислородом:
и далее образование гидроперекиси и свободного радикала:
- вырожденное разветвление в результате распада промежуточных продуктов, чаще всего гидроперекисей, например по реакциям:
а также через превращения альдегидов, образующихся при распаде перекисного радикала:
В вырожденном разветвлении существенная роль принадлежит гидроперекисям и их превращениям. Однако простой распад по связи — O—O — протекает при взаимодействии гидроперекисей с исходными углеводородами и продуктами окисления. Например, с исходными углеводородами возможна реакция:
Наличие водородных связей между молекулами реагирующих веществ оказывает влияние на кинетику окисления. Так, бимолекулярная реакция разветвления через гидроперекиси облегчается ассоциацией их в димеры:
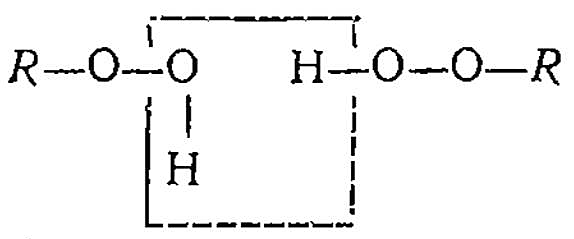
Водородные связи ослабляют связи H—O и O—O и уменьшают энергию распада димера на радикалы.
В присутствии органической кислоты распаду гидроперекиси предшествует образование комплекса:
В таком комплексе под влиянием водородных связей облегчается разрыв связи O—O в гидроперекиси. При этом молекула кислоты регенерируется. Так же осуществляется разветвление при взаимодействии гидроперекисей со спиртами и кетонами.
Скорость взаимодействия ROO – с продуктами окислительного превращения и исходными углеводородами будет тем больше, чем меньше прочность рвущихся связей C—H и O—H. При окислении алкенов наряду с гидроперекисями в результате присоединения группы —O—O— по двойной связи образуются окиси и полимерные перекиси, например:
Таким образом, в условиях низкотемпературного жидкофазного окисления углеводородов гидроперекиси являются очень важными, но не единственными первичными молекулярными продуктами окисления. Параллельно с гидроперекисями образуются различные кислородсодержащие соединения, а также окиси, циклические и полимерные перекиси. Однако образованию всех первичных молекулярных продуктов окисления предшествует образование перекисных радикалов.
В дальнейшем в реакциях окисления образуются и участвуют свободные радикалы самых различных типов.
Первичные молекулярные продукты жидкофазного окисления – гидроперекиси, как правило, сохраняют структуру окисляемого углеводорода. Строение других продуктов окисления зависит от строения перекисных радикалов и гидроперекисей. Установлено, что присоединение кислорода первоначально осуществляется по наиболее слабым связям C—H с образованием гидроперекиси ROOH. Присоединения кислорода по связям C—C с образованием перекисей ROOH в начальных стадиях окисления обычно не наблюдается.
Особенности окисления сложных смесей. Окисление горючего, содержащего различные углеводородные и неуглеводородные соединения, представляет сложный многостадийный процесс. Характер химических превращений и состав продуктов окисления зависят от вида и строения углеводородов, присутствия инициирующих и ингибирующих веществ, а также малостабильных компонентов. В сложных смесях наблюдается явление сопряженного окисления, влияющее на вырожденное разветвление. Появление в системе радикалов, образующихся в начальных стадиях превращения малостабильных компонентов горючего, вызывает цепь окислительных превращений и более устойчивых соединений. В реакцию совместного окисления включаются различного вида соединения, в том числе и стабильные углеводороды.
Окисление углеводородной части горючего начинается с окисления непредельных соединений, в первую очередь алкенов и ароматических углеводородов с ненасыщенной алифатической цепью. В дальнейшем окисляются алкилароматические, цикланоароматические и другие углеводороды. При окислении ароматических углеводородов с длинными боковыми цепями появляются кислые соединения и продукты уплотнения. Окисление ненасыщенных углеводородов приводит к реакциям конденсации и полимеризации, которые играют важную роль в образовании смол и осадков.
Процесс окисления сопровождается полимеризацией и конденсацией в первую очередь непредельных углеводородов и неуглеводородных соединений. На все стадии окислительных превращений влияют присутствующие в горючем гетероорганические соединения, особенно соединения серы, которые могут играть роль инициаторов процесса или тормозить его развитие, а также изменять состав конечных продуктов реакций.
Участие в вырожденном разветвлении сразу нескольких промежуточных продуктов ускоряет развитие процесса окисления и влияет на направление и характер процесса окисления.
Общая схема образования смол и осадков в горючем. Исходное неокисленное горючее представляет собой истинный раствор сернистых, кислородных и азотистых соединений и смолистых веществ в углеводородной среде. Первичные продукты окисления хорошо растворимы в горючем. Поэтому в процессе окисления гомогенность системы до определенного момента сохраняется. По мере развития процессов окисления, полимеризации и конденсации состав продуктов окисления усложняется. При известных условиях гомогенная система переходит в гетерогенную. Молекулы продуктов окисления, нерастворимых в горючем, объединяются и образуют коллоидные частицы. После образования первых частиц небольших размеров начинается их коагуляция. Возникающие более крупные частицы выпадают в осадок. Осадки по своей структуре состоят из аморфных и кристаллических веществ. В присутствии металлов содержание в осадках кристаллических веществ увеличивается.
На процессы образования осадков оказывают влияние:
- количество образующихся коллоидных частиц;
- вид;
- размеры и количество различных механических примесей;
- температура;
- электрическое поле;
- наличие высокомолекулярных продуктов окисления с активными функциональными группами.
Молекулы, имеющие активные функциональные группы, высокую полярность и большой дипольный момент способствуют укрупнению частиц нерастворимого в горючем осадка.
В процессе образования лаковых отложений на нагретых металлических поверхностях особенно велика роль соединений, содержащих активные функциональные группы, которые способны адсорбироваться на нагретой поверхности и коагулировать на поверхности твердые продукты окисления.
Факторы, влияющие на образование осадков и отложений
Характер процессов образования отложений и различных отложений при хранении, транспортировании и применении горючего определяют:
- время, предоставленное на развитие процессов;
- температура горючего и окружающей среды;
- контакт с кислородом воздуха;
- каталитическое действие металлов и их соединений;
- воздействие света и ионизирующей радиации;
- инициирование газами;
- склонность горючего к образованию отложений и осадков.
Влияние времени. Все стадии химических и физических превращений, связанные с процессами образования осадков и отложений, развиваются во времени. При низкой начальной температуре наблюдается очень медленное развитие химических реакций образования первичных активных продуктов, вызывающих вырожденное разветвление цепных реакций. Последующие стадии образования продуктов окисления, полимеризации и конденсации, а также физические процессы коагуляции или диспергирования частиц осадков протекают по-разному в зависимости от тормозящего или ускоряющего воздействия других факторов. Поэтому суммарные кинетические кривые накопления осадков и роста отложений имеют сложный характер, очень часто они соответствуют S-образной кривой (рис. 1).
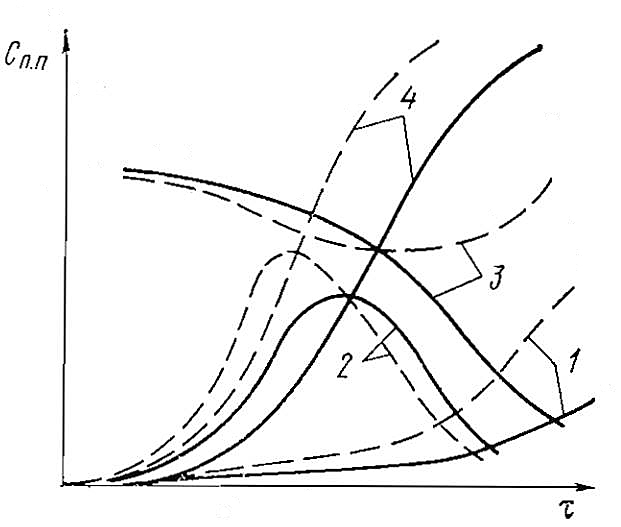
1 – нерастворимые продукты (осадки); 2 – промежуточные продукты химических превращений; 3 – непредельные соединения; 4 – растворимые продукты превращений (органические кислоты и смолы); ⎯⎯⎯⎯⎯ ⎯ температура ниже 100 °C; — — — — температура выше 100 °C
Влияние температуры. Температура реагирующей смеси существенно влияет на механизм химических превращений, определяет скорость химических и физических процессов. Индукционный период окисления горючего с повышением температуры резко сокращается, а константы скорости основных реакций окисления увеличиваются по закону Аррениуса:
С повышением температуры изменяется механизм зарождения цепей и вырожденного разветвления цепей в процессах жидкофазного окисления. При умеренной температуре (50-100 °C) вырожденно-разветвленный характер окисления углеводородного горючего обычно связан с накоплением и последующими превращениями гидроперекисей.
По мере повышения температуры увеличивается вероятность того, что перекисные радикалы подвергаются изомеризации и распаду, образуя альдегиды и алкоксильные радикалы. Чем выше температура, тем большее значение для разветвления имеют высшие альдегиды. При более высоких температурах, когда не обеспечивается целостность первоначальной структуры реагирующих веществ, развитие цепного процесса становится возможным за счет ослабления, а затем и разрыва внутримолекулярных связей в результате термической диссоциации. При этом существенно меняются направления, характер и скорость химических и физических превращений горючего. С повышением температуры (более 100 °C) снижается скорость процессов полимеризации и конденсации, все более заметную роль начинают играть деполимеризация и деструктивные превращения.
Читайте также: Основные характеристики дизельного топлива, влияющие на его качество
Принципиальная разница между низко- и высокотемпературным окислением заключается в том, что в первом случае характер процесса определяется особенностями взаимодействия с кислородом и легкостью его присоединения к углеводородам, а во втором случае – термической их деструкцией. С изменением температурного режима окисления меняется порядок расположения различных углеводородов по устойчивости к окислению. Температура оказывает влияние и на эффективность катализаторов процесса окисления. Чем ниже температура, тем больше действие катализаторов. В этих условиях катализированное окисление протекает намного быстрее некатализированного. С повышением температуры различие в скоростях этих процессов уменьшается. Это связано с тем, что при достаточно высокой температуре цепной процесс окисления способен развиваться без катализаторов, а некоторые катализаторы теряют свою активность или выпадают в осадок на сравнительно неглубоких стадиях процесса и почти не оказывают действия.
Изменение в характере химических превращений с повышением температуры можно проследить по кинетическим кривым накопления и образования промежуточных и конечных продуктов, а также по их составу (рис. 2).
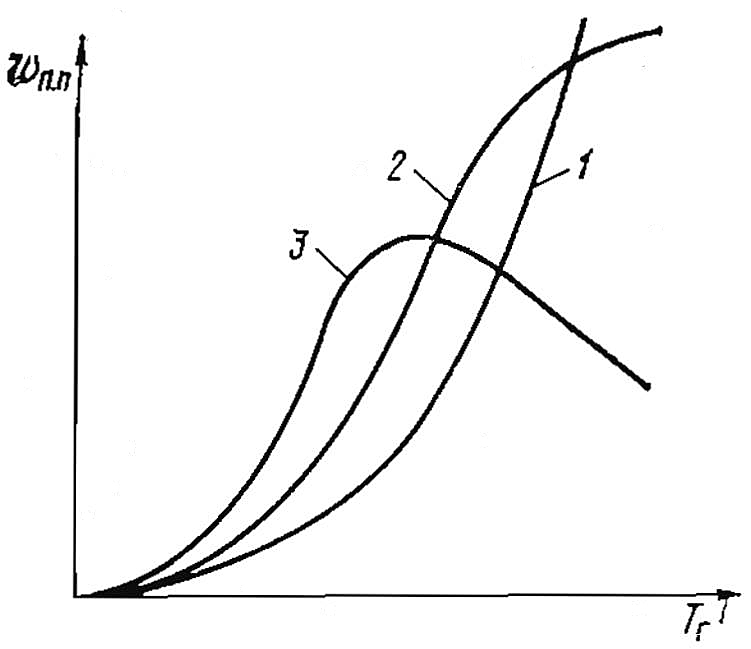
1 – органические кислоты; 2 – смолистые вещества; 3 – нерастворимые осадки
Влияние контакта с кислородом. Окисление горючего вызывается присутствием растворенного в нем кислорода воздуха, а также кислорода, диффундирующего в жидкость из внешней среды и контактирующего с поверхностью. Растворимость кислорода в углеводородном горючем выше, чем растворимость азота. Поэтому в выделяющемся из горючего воздухе содержание кислорода выше, чем в атмосферном. Количество поглощенного кислорода зависит от физических свойств горючего, давления и температуры окружающей среды. В углеводородном горючем может раствориться 10-25 % по объему воздуха.
Скорость окисления зависит от парциального давления кислорода в окружающей среде следующим образом. С ростом давления кислорода скорость окисления увеличивается сначала быстро, а затем ее рост замедляется, достигает некоторого предела и далее практически не меняется. Когда концентрация кислорода мала, реакция R— + O2 ⟶ ROO – протекает медленно по сравнению с реакциями превращения радикала ROO и в первую очередь реакцией ROO— + R′H ⟶ ROOH + R′. Поэтому с ростом концентрации кислорода скорость окисления увеличивается. Когда концентрация кислорода велика, скорость реакции R— + O2 ⟶ ROO не зависит от концентрации кислорода, а процесс лимитируют реакции превращения перекисного радикала ROO—.
Действие металлов. Металлы оказывают катализирующее действие на жидкофазное окисление горючего и влияют на эффективность действия антиокислителей.
Действие металлов проявляется либо в ионной форме, либо в виде высших окислов и солей органических кислот, когда они способны вступать в реакции с исходными углеводородами и продуктами их окисления. При этом металл меняет свою валентность и образует свободные радикалы. Каждая молекула катализатора может многократно принимать участие в инициировании цепей, вызывая превращение молекулярных продуктов в радикалы. Интенсификация окисления горючего в присутствии катализатора вызывает ускоренный расход антиокислителя. В ряде случаев металлы непосредственно воздействуют на антиокислитель.
В среде полярных растворителей соли металлов диссоциируют на ионы.
Зарождение радикалов под действием ионов металлов осуществляется по схемам: – с исходными углеводородами:
— с продуктами окисления:
При окислении углеводородов катализ осуществляется не ионами, а молекулами солей металлов переменной валентности:
В подобные реакции могут вступать спирты и кетоны. Однако, реагируя со свободными радикалами, соли металлов могут обрывать реакционные цепи:
Инициирующая функция катализатора обычно проявляется гораздо сильнее и может маскировать его тормозящее действие на окисление.
Световое излучение и ионизирующая радиация могут вызвать образование радикалов, инициирующих процесс окисления углеводородов.
В присутствии сенсибилизаторов – веществ, интенсивно поглощающих свет, последующая передача энергии от этих веществ молекулам углеводородов вызывает диссоциации некоторых слабых связей C—H или C—C.
Под действием поглощенного кванта света молекула A сенсибилизатора (некоторые красители) переходит в возбужденное состояние, присоединяет к себе молекулу кислорода. Затем перекисный радикал реагирует с молекулой углеводорода и образует гидроперекись и свободный радикал:
Ионизирующая радиация вызывает возбуждение молекул, которые диссоциируют на свободные радикалы:
Газы-инициаторы, например:
- двуокись азота,
- озон,
- хлор,
- бромистый водород,
способны в известных условиях инициировать процесс окисления. Возможно непосредственное взаимодействие инициаторов с углеводородами:
а также образование в системе реагирующих веществ, способных распадаться на свободные радикалы.
Антиокислительные и диспергирующие присадки
Антиокислители (ингибиторы окисления) при хранении и применении горючего могут использоваться самостоятельно или являться составной частью многокомпонентных присадок. Действие антиокислителей (AH) основано на их участии в процессах окисления. Они взаимодействуют с алкильными радикалами, дающими начало окислительным цепям с алкоксильными и перекисными радикалами или с гидроперекисями, и препятствуют образованию при их превращениях активных радикалов.
Большинство антиокислителей реагирует с перекисными и алкильными радикалами, образуя малоактивные радикалы:
Реакция антиокислителя с перекйсными радикалами может осуществляться через образование малоустойчивого комплекса антиокислителя с радикалом, который, реагируя с перекисными радикалами, образует стабильные продукты:
Малоактивные радикалы антиокислителя (A—) подвергаются дальнейшим превращениям. Они могут рекомбинироваться в молекулу антиокислителя, снова обладающую свойствами антиокислителя. Молекула антиокислителя может многократно участвовать в химических превращениях. Однако антиокислитель реагирует не со всеми свободными радикалами. Он расходуется при дальнейшем превращении радикалов A— в другие продукты (например, A— + RH ⟶ AH + R—), участвует в побочных реакциях окислителя. Вследствие этого окисление топлива развивается и в присутствии антиокислителей, хотя и тормозится по времени. Поэтому во избежание развития окислительных превращений и последующего образования смолистых веществ, а также различного вида отложений в горючее необходимо добавлять и другие присадки – деактиваторы металлов для подавления их каталитического действия и диспергирующие, препятствующие выделению осадков из топлива, и т. д.
Антиокислительным эффектом обладают:
- фенолы,
- амины и аминофенолы.
Они действуют по различным механизмам и при совместном введении в горючее могут оказывать синергетический эффект, дополняя и усиливая действие друг друга, а также обеспечивая значительный суммарный результат. Например, при действии двух антиокислителей (AH) и (BH) один из них может служить антиокислителем другого:
При этом:
- радикал A— непрерывно регенерируется;
- а образующийся радикал B— является менее активным.
Синергетическими парами могут служить акцептор свободных радикалов (амин, фенол) и антиокислитель, взаимодействующий с перекисями (например, серосодержащий). Синергизм установлен при действии амина и фенола или двух фенолов различного строения.
Суммарная эффективность антиокислителей выше, если их вводить в топливо порциями, чтобы концентрация их все время была оптимальной.
В практике используют как технические продукты, так и индивидуальные синтетические соединения или их смеси. Так, за рубежом применяют н-бутил-n-аминофенол, изо-бутил-n-аминофенол, N, N′-дивтор-бутил-n-фенилендиамины, экранированные алкилфенолы:
- 2,6-дитрет-бутил-4-метилфенол (26В4М);
- 2,4-ди-метил-6-трот-бутилфенол (24М6В);
- а также 2,6-дитретбутилфенол.
Основные виды антиокислителей приведены в таблице.
| Основные виды антиокислителей | ||||
|---|---|---|---|---|
| Наименование и условное обозначение антиокислителей | Формула | Концентрация в топливе, % | Температура плавления, °C | Растворимость в бензине, мг/100 мл |
| 2,4-диметил-6-трет-бутилфенол (24 М6В) | 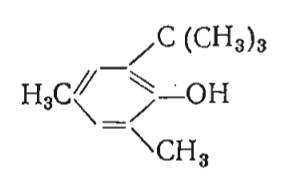 | 0,002-0,04 | – | Не ограничена |
| 2,6-ди-трет-бутил-4-метилфенол (26 В4М) | 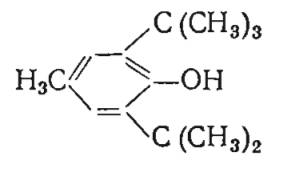 | 0,002-0,04 | 69-70 | Очень хорошая |
| Бутил-n-аминофенол (БАФ) | 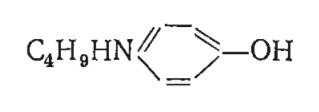 | 0,002-0,005 | -30 | 350-560 |
| n-оксидифениламин (ПОДФА) | 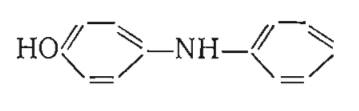 | 0,007-0,01 | 30 | 60-90 |
| N, N′-ди-втор-бутил-n-фенилендиамин (ФДА) | 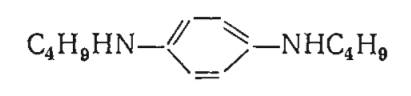 | 0,001-0,01 | 15 | Не ограничена |
| Угольная смола (УСА) | Фенольная фракция 260-300 °C | 0,05-0,15 | – | Достаточно хорошая |
| Древесная смола (ДСА) | Фенольные фракции 260-290 °C | 0,05-0,15 | – | Хорошая |
| α-Нафтол | 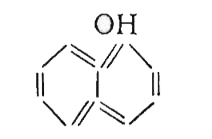 | 0,013 | 94 | 560-1 500 |
Древесно-смольный антиокислитель (ДСА) представляет собой фенольную фракцию 260-290 °C, а антиокислитель УСА — фракцию 260-300 °C технических фенолов из подсмольных вод смолы полукоксования углей. Антиокислитель УСА трудно растворяется в углеводородном топливе, его вводят в виде 30 %-ного раствора в ароматическом растворителе:
- бензоле,
- толуоле,
- ксилоле,
- алкилбензоле
Активной частью ДСА являются многоатомные фенолы и их метиловые и диметиловые эфиры. Активная часть антиокислителя УСА – это одно- и двухатомные фенолы (содержание их – не менее 85 %).
Антиокислители наиболее эффективно действуют в легких топливах. Присутствие антиокислителя уменьшает степень развития процессов, предшествующих выделению твердой фазы, до определенной температуры (примерно не выше 100-150 °C).
В топливах дизельных и более тяжелых развитие окислительных превращений определяется не только окислением углеводородной части. В образовании нерастворимых продуктов при хранении Особенности работы топливовпрыскивающей аппаратуры на тяжелых топливахтяжелых топлив большую роль играет значительное содержание высокомолекулярных углеводородов и неуглеводородных соединений. Такие топлива менее чувствительны к ингибированию антиокислителями. Поэтому антиокислители к дизельным и более тяжелым топливам добавляются в качестве составной части многофункциональных стабилизирующих присадок. Такие присадки содержат деактиваторы металлов и диспергенты.
К гидроочищенным дизельным топливам для стабилизации могут быть добавлены антиокислители типа аминов или их смеси. Например, зарубежная присадка-антиокислитель для дизельных топлив Ethyl-703 содержит 2,6-ди-трет-бутил-диметиламино-n-крезол, а присадка Du Pont Foa-3 – смесь органических аминов.
Для стабилизации дизельных и остаточных топлив, предотвращения образования в них осадков при хранении и применении используют стабилизаторы-диспергенты.
Стабилизаторы-диспергенты предотвращают образование осадков или диспергируют уже образовавшиеся осадки.
В качестве стабилизаторов-диспергентов применяют различные присадки зольного и беззольного типа. Из беззольных присадок распространение получили полярные полимеры и алкиламины, а из зольных присадок – нефтяные сульфонаты различных металлов, прежде всего бария.
Полярные полимеры представляют собой продукты совместной полимеризации мономеров двух типов – неполярного, обеспечивающего растворимость присадки в топливе, и поверхностно-активного, способного к притяжению поверхностно-активных продуктов, образующих осадки. В качестве поверхностно-активных мономеров используют эфиры и амиды метакриловой и акриловой кислот, виниловые эфиры карбоновых кислот или винилзамещенные органические соединения и т. д.
Эффективными диспергирующими присадками к дизельным и котельным топливам являются сополимер додецилметакрилата (80 %) и диэтиламиноэтилмета-крилата (20 %).
Промышленные стабилизаторы-диспергенты для дистиллятных топлив выпускаются под различными фирменными наименованиями, например присадка Foa-2 американской фирмы «Du Pont» (Fuel Oil-2 additive). Она является сополимером, в который входят активные полярные и растворимые в топливе группы в точно установленном соотношении, и имеет среднюю молекулярную массу около 50 000.
Полярные полимеры эффективны как в дистиллятных, так и в остаточных топливах различного назначения (дизельные, котельные). Их добавляют в концентрации от 0,0015 до 0,02 %. Наиболее распространенная концентрация находится в пределах 0,005-0,01 %. Добавленные в таких концентрациях в топливо присадки проявляют ярко выраженную способность замедлять или снижать образование нерастворимых осадков и позволяют получить топливо, обладающее хорошими свойствами даже после длительного хранения. Наряду со способностью предотвращать образование осадков при хранении присадки противодействуют также конгломерации уже содержащихся в топливе нерастворимых осадков, диспергируя их в виде мелких частиц, в результате чего они проходят через отверстия и поры фильтров.
Кроме того, присадки устраняют несовместимость топлив. В дизельных топливах присадки эффективно предотвращают зависание игл распылителей форсунок, возникающее в результате образования на них лаков и осадков при высоких температурах.
Полимерные присадки можно применять вместе с другими диспергентами, антиокислителями, ингибиторами коррозии и деактиваторами металлов. Зольные диспергирующие присадки содержат соли органических кислот (бария и других металлов).
