Горючее является основным энергетическим ресурсом, используемым в различных отраслях промышленности и транспортных средствах. Качество и характеристики горючего напрямую влияют на эксплуатационные свойства двигателей и оборудования, а также на экологическую безопасность окружающей среды.
Цель данной статьи – рассмотреть эксплуатационные свойства горючего, особенности его качества, влияние на работу двигателей и сравнение различных видов горючего по их характеристикам. Мы также рассмотрим важные факторы, которые должны учитываться при выборе горючего для конкретных целей.
Классификация горючего и общая характеристика эксплуатационных свойств
В основу классификации горючего (рис. 1) положены главные и соподчиненные принципы:
- главные:
a) связанные с основными требованиями к качеству горючего для СЭУ, которые определяются энергетическими потребностями и принципиальными различиями в организации рабочего процесса СЭУ (деление горючего на группы);
б) связанные с требованиями к качеству горючего, учитывающими назначение судовой техники, особенности конструкции СЭУ, а также наличие сырьевых ресурсов (деление на сорта);
- соподчиненные, связанные с условиями использования судовой техники, условиями хранения и транспортировки горючего, а также с технологией его получения (деление на марки).
Классификация горючего для судовой техники
На рис. 1 выделены марки горючего, являющиеся основными для вновь разрабатываемой и модернизируемой судовой техники.
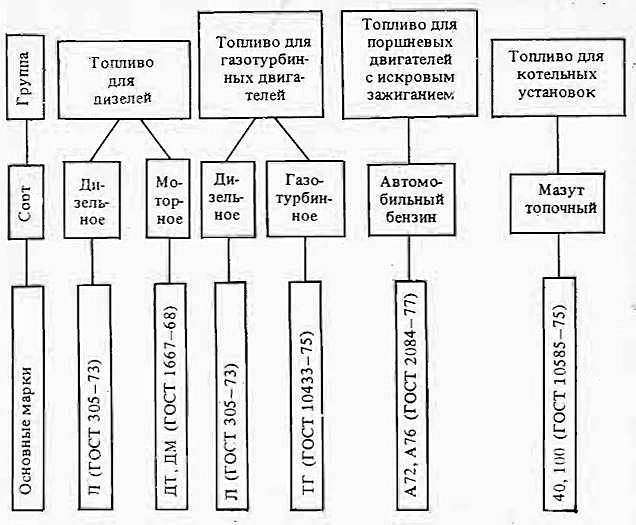
Это горючее в настоящее время обеспечено сырьевыми ресурсами. Дублирующие марки имеют ограниченные сырьевые ресурсы, по уровню качества они приближаются к основной марке, а некоторые превосходят ее. Марки горючего более низкого качества, чем основные, являются резервными, допускается лишь кратковременное их использование. К резервным относятся также различные топливные смеси и углеводородные топлива с добавками спиртов, фракций переработки сланцев и углей, Водотопливная эмульсия и ее преимущества при использовании в дизельных двигателяхводотопливные эмульсии и т. д.
Общие эксплуатационные свойства горючего
Эксплуатационные свойства горючего определяются совокупностью специфических физико-химических характеристик Термин «физико-химические характеристики» используется как обобщающий для оценки свойств горючего, в совокупности которых проявляются его эксплуатационные свойстваx, обусловливающих скорость физико-химических процессов, протекающих при хранении, транспортировке, применении горючего и взаимодействии его с окружающей средой. Большинство этих процессов является сложными, включающими комплекс взаимосвязанных более простых. К сложным процессам относятся:
- подача топлива в двигатели,
- смесеобразование,
- воспламенение,
- горение,
- образование различных видов отложений,
- коррозия и т. д.
Каждый из них включает более простые процессы, условно назовем их элементарными. Например, смесеобразование в двигателях может включать следующие элементарные процессы:
- распыливание топлива,
- распределение распыленного топлива в камере сгорания,
- испарение капель топлива и перемешивание паров топлива с воздухом.
В свою очередь каждый из указанных элементарных процессов смесеобразования можно анализировать отдельно и рассматривать как сложный по отношению к более простым составляющим его процессам.
В общем виде зависимости между скоростью как суммарных, так и элементарных процессов, условиями их протекания, эксплуатационными свойствами или физико-химическими характеристиками горючего имеют вид:
где:
- wΣ — скорость суммарного и элементарного физико-химического процессов соответственно;
- Фм — факторы, учитывающие механизм процесса;
- Фу — факторы, учитывающие условия протекания процесса;
- Фк — факторы, учитывающие конструкции двигателей, технических систем, установок, приборов;
- xΣ и xi — эксплуатационные свойства и физико-химические характеристики горючего соответственно.
Общие для всех групп горючего эксплуатационные свойства и физико-химические характеристики, определяющие эти свойства, даны в табл. 1.
| Таблица 1. Основные эксплуатационные свойства горючего и физико-химические характеристики, определяющие эти свойства | |
|---|---|
| Эксплуатационные свойства | Физико-химические характеристики |
| 1. Энергетические свойства | Количество тепловой энергии, которое может быть выделено при полном сгорании, и термодинамические свойства продуктов сгорания. |
| 2. Прокачиваемость | Плотность, вязкость, упругость паров, способность кристаллизоваться, застывать, поглощать влагу (гигроскопичность) и удерживать частицы загрязнений (загрязняемость). |
| 3. Испаряемость | Упругость паров и способность их к взаимной диффузии – перемещению; теплоемкость, теплопроводность, теплота испарения. |
| 4. Воспламеняемость | Способность к физическим и химическим предпламенным превращениям горючей смеси, вызывающим воспламенение; температуропроводность паров. |
| 5. Горючесть | Способность к химическим и физическим превращениям горючей смеси, определяющим распространение зоны реакции (фронта пламени). |
| 6. Склонность к отложениям | Способность к химическим превращениям с образованием нерастворимых в горючем продуктов, способность удерживать и коагулировать эти продукты, адсорбироваться на поверхности металлов. |
| 7. Коррозионность | Способность к физическому, химическому или электрохимическому взаимодействию с конструкционными материалами, вызывающему их разрушение. |
| 8. Стабильность | Способность к физическим и химическим превращениям, вызывающим изменение эксплуатационных свойств (испаряемость, окисляемость, термическая устойчивость и др.) |
| 9. Токсичность | Способность вызывать поражения организма человека. |
Как видно из таблицы, эксплуатационные свойства получают наименование в соответствии с названием соответствующего сложного физико-химического процесса.
Кроме указанных общих эксплуатационных свойств горючего для конкретных групп можно выделить свои специфические свойства.
Механизмы процессов образования отложений весьма разнообразны. Поэтому целесообразно отдельно рассматривать лако- и нагарообразующую способность, а также моющие свойства горючего. Для некоторых групп горючего имеют важное значение также охлаждающая способность, противоизносные и другие свойства. Чтобы оценить суммарные процессы, протекающие при хранении, транспортировке и применении горючего, необходимо выявить их механизм, закономерности развития, влияние конструктивных факторов и условий их протеканий. Особое значение имеют физико-химические характеристики эксплуатационных свойств горючего, которые влияют, а в некоторых случаях определяют скорость того или иного суммарного процесса. Отдельно взятые элементарные процессы еще не дают представления о суммарном сложном процессе, хотя тот или иной элементарный процесс может определять какую-то стадию сложного.
Например, в некоторых условиях развития горения скорость его может зависеть от скорости смешения или испарения. Однако это не значит, что процессы смешения или испарения определяют сущность процесса горения. Для понимания механизма рассматриваемых сложных процессов, особенностей развития их отдельных стадий необходимо знать основные закономерности протекания элементарных процессов и особенности их взаимного влияния.
Важнейшими элементарными процессами являются:
- фазовые переходы – скачкообразные изменения состояния вещества, к которым относятся плавление;
- испарение;
- взаимные превращения различных кристаллических модификаций вещества, различающихся строением или составом;
- передача теплоты и вещества молекулярной теплопроводностью и молекулярной диффузией;
- простые и сложные химические реакции, гомогенные и гетерогенные;
- многочисленные виды физического и химического взаимодействия на различных поверхностях раздела:
- жидкость и твердое тело,
- жидкость-воздух,
- жидкость-газ и т. д.
Развитие физических процессов – передача теплоты и вещества, фазовые переходы и др. – определяется теплофизическими свойствами горючего:
- плотностью,
- вязкостью,
- теплопроводностью,
- теплоемкостью,
- температурами плавления и кипения и др.
Развитие химических превращений определяется Характеристики топлива для судовых дизелейхимическими свойствами горючего, зависящими от строения молекул, вида и прочности связей в молекуле, а также от особенностей взаимодействия электронных оболочек с внешним электрическим полем.
Рассмотрим кратко некоторые элементарные процессы, а также физико-химические характеристики горючего, определяющие скорость их протекания.
Процессы передачи теплоты и вещества
Процессы передачи теплоты и вещества подобны. Передаче теплоты молекулярной теплопроводностью соответствует молекулярная диффузия, передач теплоты конвекцией – конвективная диффузия. Передача теплоты излучением не имеет аналогии в процессах передачи вещества.
В неподвижной среде тепловой поток (передача молекулярной теплопроводностью или кондукцией) пропорционален градиенту температур:
где:
- qТ – количество тепла, передаваемого через единицу поверхности в единицу времени;
- λ – коэффициент теплопроводности, физическая константа вещества, в котором происходит передача теплоты;
- – производная от температуры по координате, направленной по нормали к поверхности, через которую происходит передача теплоты.
Диффузионный поток qс – количество вещества, переносимого через единицу поверхности в единицу времени, – соответственно пропорционален градиенту концентрации:
где:
- DC – коэффициент диффузии – физическая константа диффундирующего вещества;
- C – концентрация диффундирующего вещества.
При переносе теплоты или вещества массовым потоком газа или жидкости как целого (конвекцией) выражения (2) и (3) должны быть дополнены конвективными членами, выражающими этот перенос:
где:
- ux – составляющая скорости потока u в направлении x;
- C – теплоемкость;
- ρ – плотность.
Для расчета процесса передачи теплоты и вещества при конвективном движении прибегают к эмпирическим коэффициентам. Для процессов теплопередачи отношение теплового потока к разности температур называют коэффициентом теплопередачи:
Для процессов переноса вещества отношение диффузионного потока к разности концентраций βC называют константой скорости диффузии:
С точки зрения размерности величина βС соответствует не χ, а χ/cρ.
При нахождении коэффициентов χ и βC обычно используют экспериментальные данные. Способы обобщения экспериментальных данных берут из теории подобия. Она основана на положении, что реальные закономерности не зависят от выбора системы единиц измерения и потому могут быть представлены в виде зависимостей между безразмерными величинами — критериями подобия.
Для определения коэффициентов χ и βс можно воспользоваться критериями Нуссельта Nu и Маргулиса M.
Для процессов теплопередачи:
Для процесса диффузии:
где:
- L — линейный размер;
- u — линейная скорость потока.
Для тел заданной геометрической формы критерии Нуссельта и Маргулиса являются функциями других безразмерных величин, выражающих физические свойства среды (критерий Прандтля Pr) и характер движения газа или жидкости (при вынужденной конвекции — критерий Рейнольдса Re, при свободной конвекции — критерий Грасгофа Gr).
Вид зависимостей Nu = f (Re; Pr); M = φ (Re; Pr) определяют из анализа экспериментальных данных; зная указанные зависимости, легко найти χ и βC:
В случае ламинарного потока критерий Нуссельта приближается к постоянному значению, в случае турбулентного потока к постоянному значению приближается критерий Маргулиса.
Различными исследователями предложен ряд формул для Nu = f (Re; Pr) и M = φ (Re; Pr), которые во многих случаях мало различаются. Так, для обтекания изолированного тела потоком:
где:
- m = 0,4 ÷ 0,67;
- n = 0,3 ÷ 0,4.
Значения m, n, а также коэффициент k зависят от геометрической формы обтекаемого тела и степени турбулизации набегающего потока. При малых значениях Re для шара критерий Нуссельта стремится к предельному постоянному значению Nu = 2.
Химические превращения. Химические реакции разделяются на гомогенные, протекающие в объеме, и гетерогенные, протекающие на поверхности раздела. Скорость гомогенной реакции выражается количеством вещества, реагирующим в единице объема за единицу времени. Эта величина пропорциональна изменению концентрации вещества за единицу времени. Скорость гетерогенной реакции определяется как количество вещества, реагирующего на единице поверхности за единицу времени, и непосредственно не связана с изменением концентрации.
В обоих случаях скорость реакции является функцией температуры и концентрации веществ, участвующих в реакции.
Все гомогенные и гетерогенные реакции делятся на простые и сложные. Скорость простых реакций зависит только от концентрации исходных веществ и не зависит от концентрации образующихся продуктов. Скорость сложных реакций зависит от концентрации как исходных веществ, так и образующихся конечных или промежуточных продуктов. Концентрация конечных и промежуточных продуктов сильно меняется со временем, потому эта зависимость приобретает характер кажущейся зависимости скорости сложной реакции от времени.
Скорость гомогенной реакции определяется выражением:
где:
- k — константа скорости реакции;
- CA, CB, ….., — концентрации веществ A, B, …, участвующих в реакции (исходных, промежуточных, конечных);
- nA, nB — порядок реакции.
Различают порядок реакции по отдельному веществу (например, порядок реакции по веществу A есть показатель nA) и суммарный порядок реакции, равный сумме всех показателей. Для газовых реакций суммарный порядок называют порядком по общему давлению.
Константа скорости реакции в зависимости от температуры T, газовой постоянной R и энергии активации E определяется законом Аррениуса:
Энергия активации представляет собой энергию, которой должна обладать молекула, чтобы прореагировать.
Энергия активации E, газовая постоянная R и предэкспоненциальный множитель Z являются характерными величинами для данной химической реакции.
Большинство химических реакций протекают с образованием активных промежуточных продуктов. В гомогенных реакциях первой стадией является обычно образование активных промежуточных продуктов из исходных продуктов. Активными промежуточными продуктами могут быть свободные радикалы и свободные атомы, а также довольно сложные и относительно стабильные молекулы, обладающие повышенной реакционной способностью, например органические перекиси.
Для взаимодействия промежуточных активных продуктов с исходными требуется сравнительно малая энергия активации. Но при первичном образовании активных продуктов из стабильных молекул необходима значительная энергия активации и, следовательно, взаимодействие не может происходить с большой скоростью. В гетерогенных реакциях роль промежуточных продуктов могут играть молекулы, химически адсорбированные на поверхности.
На однородной поверхности зависимость количества адсорбированного вещества Gад от парциального давления pг этого вещества в газовой фазе определяется выражением:
где:
- k и A — постоянные величины.
Аналогичный вид имеет зависимость скорости реакции на однородной поверхности от концентрации реагирующих веществ в газовой фазе.
На неоднородной поверхности различные участки поверхности характеризуются неодинаковыми теплотой адсорбции и энергией активации. При этом зависимость количества адсорбированного вещества Gад от парциального давления pг его в газовой фазе выражается формулой:
где:
- k и n — постоянные величины (n > 1).
При протекании сложных гетерогенных реакций продукты реакций образуют на поверхности твердую пленку, сквозь которую должны диффундировать реагирующие вещества. Так, при окислении металлов кислородом воздуха на поверхности металла образуется твердая пленка окисла, через которую диффундирует кислород.
При стационарном распределении концентрации диффундирующего вещества, которое устанавливается по истечении определенного времени, скорость диффузии через пленку обратно пропорциональна ее толщине δ, а скорость роста пленки пропорциональна количеству проникающего через нее газа:
где:
- τ — время;
- A — постоянная, пропорциональная произведению коэффициента диффузии на скорость реакции.
Интегрируя, получаем:
Таким образом, скорость реакции:
Характер протекания химических реакций на поверхности металлов весьма разнообразен. В данной статье необходимо выделить процессы:
- поверхностного химического взаимодействия, при котором поверхность металла выступает в роли катализатора химических реакций, но сама некоторое время не изменяется;
- хемосорбцию — металл вступает в химическую реакцию с веществами среды и продукты реакции закрепляются на поверхности металла с образованием самостоятельной хемосорбционной фазы. Толщина пленки хемосорбционной фазы может быть от 100-200 м-10 до 1-2 мм;
- химическую коррозию в среде горючего – непосредственное взаимодействие металла со средой, при котором процессы окисления и восстановления осуществляются в одном акте, сопровождаются поглощением или выделением теплоты и не вызывают в металле появление электрического тока.
Энергия химических связей представляет собой одну из главных характеристик молекулы, определяющих особенности ее строения и разнообразные химические свойства.
В наинизшем энергетическом состоянии молекулы число связей между отдельными, входящими в ее состав атомами максимально. При разрыве одной или нескольких связей изменяется энергетическое состояние молекулы. Если разрыв какой-то связи приводит к распаду (диссоциации) молекулы на две части, то энергия разрыва этой связи будет равна разности теплоты образования продуктов диссоциации и теплоты образования исходной молекулы. Так, энергия разрыва связи R1-R2 молекулы R1R2 (или теплота диссоциации молекулы R1R2 на R1 и R2) равна:
где:
- Q0 — энергия разрыва связей;
- – теплота образования при 0 К соответственно для R1 и R2, а также для R1R2 из элементов в стандартных состояниях.
Средние значения энергии некоторых связей при полной диссоциации газообразных веществ до газообразных атомов приведены в табл. 2.
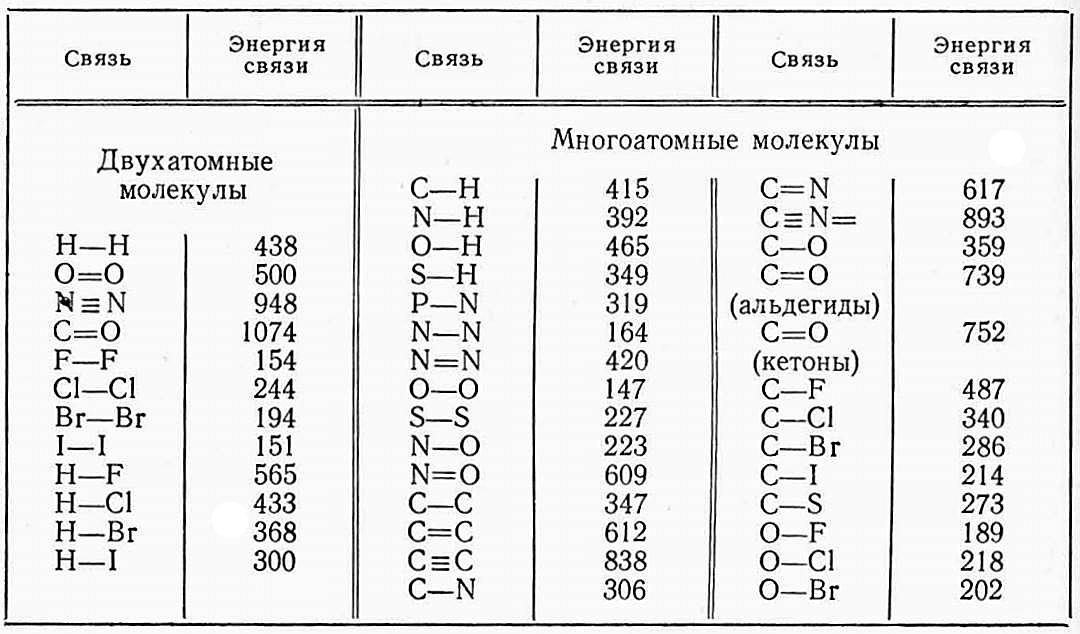
Следует учитывать, что энергии одних и тех же связей, например C—C, C—H, неодинаковы в различных соединениях.
Простые связи C—H при углероде, связанном двойной связью (X—C=C) приблизительно на 17 кДж прочнее, чем обычные простые связи C—H в соединении X—C—C, а простая связь при углероде, связанном тройной связью, приблизительно на 50 кДж прочнее, чем простые связи в соединении X—C—C. Поэтому существует понятие энергии диссоциации связей, значения которой для ряда соединений приведены в табл. 3.
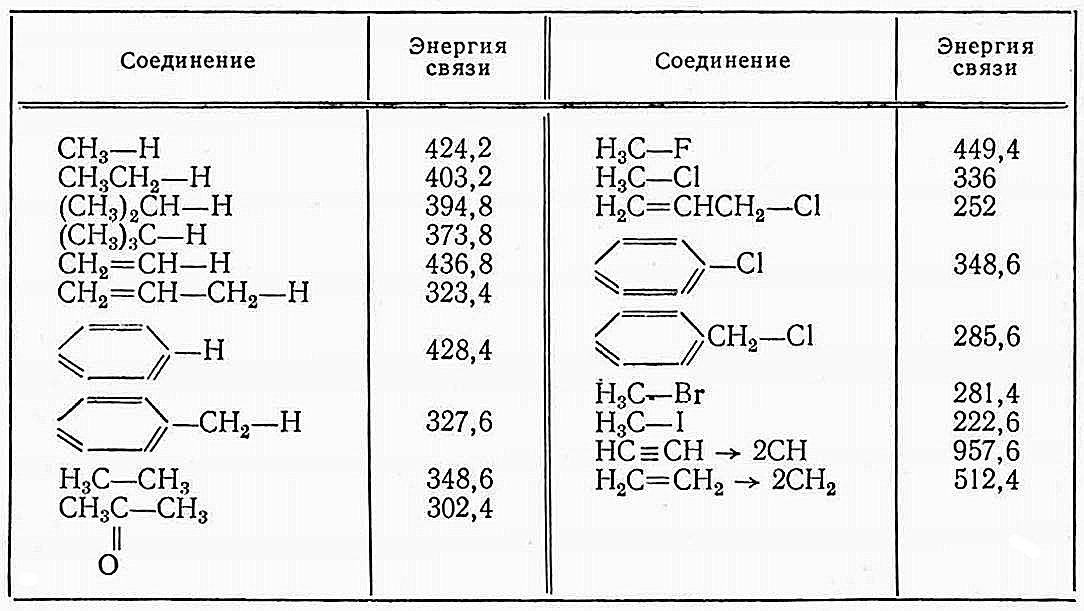
При расчете теплоты реакции (теплоты сгорания) Qг используются средние значения энергии связи (см. табл. 2).
Химическая связь атомов в молекуле делится на:
- гетерополярную (электровалентную) — один, или несколько электронов электроположительного атома полностью переходят на электронную оболочку электроотрицательного атома;
- гомеополярную (ковалентную σ-связь), образующуюся за счет общей для двух атомов пары электронов;
- координационную — разновидность ковалентной связи, осуществляемую за счет неподеленной пары электронов, принадлежавшей сначала только одному атому.
Например, в n-нитроалкилбензоле:
имеются ковалентные связи C—C, C—H и координационная связь в группе NO2:
Взаимодействие атомов и молекул компонентов горючего с внешней средой. Для определения характера взаимодействия молекул между собой и окружающей средой существенное значение имеют полярные и электронодонорно-акцепторные свойства.
Молекула называется неполярной, если ее дипольный момент в отсутствие внешнего электрического поля равен нулю, и полярной, если молекула обладает постоянным дипольным моментом. Дипольный момент молекул позволяет получить данные для выяснения природы химических связей, структуры молекул и взаимного влияния атомов и атомных групп в молекуле. Единица дипольного момента дебай (Д) равна 1/3 · 10-29 эл. ст. ед. см.
Читайте также: Эксплуатация топливных систем высокого давления
Под полярностью молекул понимают стационарное смещение электронов отдельных атомов молекулы или атомных групп, приводящее к появлению электрического дипольного момента. В таких молекулах центр положительных зарядов не совпадает на ту или иную величину с центром отрицательных зарядов.
Если ковалентной связью объединены в молекулы различные атомы, электроны смещаются в сторону более электроотрицательных атомов или групп, и молекула приобретает полярность. Этот эффект называют статическим индукционным ls. Он может быть отрицательный (-ls) и положительный (+ ls). Атомы и группы притягивающие электроны сильнее, чем атом водорода, вызывают отрицательный эффект. Атомы и атомные группы, отталкивающие валентные электроны (притягивающие их слабее, чем водород), вызывают положительный эффект.
Положительным эффектом (+ ls) обладают металлоорганические соединения ⟶ C ⟵ Me, алкильные радикалы (в порядке увеличения) —CH3, —CH2—CH3,
Индукционный статический эффект передается по C—C связи, но не дальше, третьего-четвертого атома углерода. Если обычная σ-связь приводит к возникновению полярности в молекуле (ls-эффект), то в молекулах с двойными и тройным и связями (π-связи) может осуществляться статическое электронное смещение, называемое эффектом сопряжения (мезомерный эффект или таутомерный эффект).
Обычно статическое электронное смещение невелико. Полярность молекулы главным образом связана со статическим индукционным эффектом. Динамический индукционный эффект ld возникает при воздействии на атомы молекулы, соединенные σ-связью, внешних факторов — других полярных молекул, ионов или электрического поля.
Динамический индукционный эффект играет большую роль в процессах адсорбции и хемосорбции поверхностно-активных веществ (ПАВ) на металлических поверхностях, несущих на себе значительные заряды. Поляризуемостью молекул называют их способность приобретать или увеличивать свою полярность под воздействием внешних факторов. На поляризуемость молекулы сильно влияет динамическое электронное смещение. Под воздействием внешнего фактора усиливается электронное смещение двойных или тройных π-связей, вплоть до полного перескока π-электронной пары.
Динамическое электронное смещение считают отрицательным (– Ed), если атом или группа атомов принимает смещенные π-электроны и приобретает отрицательный заряд. Динамическое электронное смещение положительно (+ Ed), если атом или группа атомов отдает π-электронную пару, т. е. приобретает положительный заряд.
Взаимодействие молекул под влиянием сил Ван-дер-Ваальса представляет собой:
- взаимодействие молекул с постоянным дипольным моментом μs – ориентационное взаимодействие;
- индукционное взаимодействие – молекула A, обладающая постоянным дипольным моментом μsA, взаимодействует с молекулой B, дипольный момент которой μdB наведен молекулой A;
- взаимодействие двух неполярных молекул A и B под действием дисперсионных сил. Это связано с возможностью взаимного обмена электронами между молекулами, а также тем, что неполярные молекулы могут иметь мгновенные дипольные моменты, среднее значение которых по времени равно нулю.
Межмолекулярные водородные связи определяются электростатическими и донорно-акцепторными взаимодействиями между молекулами — донором водорода (AH) и акцептором водорода (B).
Энергия водородной связи составляет 8,4-63 кДж/моль, что значительно больше Ван-дер-Ваальсовых сил – около 4,2 кДж/моль, но гораздо меньше энергии химических связей 336-630 кДж/моль (30-150 ккал/моль).
Межмолекулярные водородные связи могут образовываться между молекулами одного и того же вещества и разных веществ. Эта связь во многом определяет ассоциацию молекул. Благодаря водородной связи происходит ассоциирование молекул воды, спиртов, органических кислот, аминов и т. д. При этом увеличивается молекулярная масса, образуются ассоциаты, имеющие аномалию по температурам плавления и кипения, может меняться растворимость поверхностно-активных веществ.
Вещества лучше растворяются в подобных им растворителях со сходным строением молекул:
- полярные молекулы лучше растворяются в полярных растворителях,
- а неполярные или слабо полярные – в неполярных растворителях.
Например, растворимость ПАВ в нефтепродуктах зависит от энергии связи молекул ПАВ с молекулами углеводородной среды. Эта энергия в значительной степени определяет механизм действия и особенности применения ингибиторов и других присадок в топливах, маслах и смазках.
Образование H-комплексов (AH…B) приводит к изменению полярности, поляризуемости и дипольного момента ассоциатов. Как правило, дипольный момент ассоциата μкм больше суммы дипольных моментов молекулы донора μAH и молекулы акцептора μB:
Одним из видов межмолекулярного взаимодействия является образование электронодонорно-акцепторных комплексов (ЭДА-комплексов).
Электронодонорно-акцепторное взаимодействие заключается в межмолекулярном переносе заряда (электронов) от донорного компонента к акцепторному компоненту. Степень переноса может быть различной: от сдвига электронов донора в сторону акцептора до полного их переноса. Образующиеся при этом электронодонорно-акцепторные комплексы (ЭДА-комплексы) могут быть первыми продуктами химического взаимодействия веществ.
Донорами электронов Д могут быть молекулы с неподеленными электронными парами (с σ-связями, π-связями), например:
- амины,
- непредельные и ароматические углеводороды,
- сульфиды,
- эфиры,
- спирты и кетоны.
Акцепторы A должны иметь дефицит электронов в каком-нибудь звене молекулы. В качестве акцепторов в ЭДА-комплексах известны галогены, хиноны, ароматические нитросоединения, сульфоны. ЭДА-комплексы играют существенную роль в процессах адсорбции и хемосорбции ПАВ на металлах.
По величине энергетического взаимодействия ЭДА-комплексы наряду с H-комплексами занимают промежуточное положение между адсорбцией (Ван-дер-Ваальсово взаимодействие) и хемосорбцией (химическая связь).
Ионное межмолекулярное взаимодействие обеспечивает наивысшую энергию связи ПАВ и в объеме растворителя и на поверхности твердого тела. Возникновение ионов ПАВ по связям C—X, где:
- X – активная функциональная группа, и гетеролитический (ионный) распад наряду с гомолитическим (радикальным) распадом может оказывать существенное влияние на процессы образования осадков, коррозии и другие процессы.
Методы оценки эксплуатационных свойств горючего
Оценка эксплуатационных свойств включает:
- определение физико-химических характеристик на основе зависимости wi = fi(Фм, Фу, Фк, xi), из которой при Фм, Фу, Фк = const находят величины, характеризующие тот или иной процесс – параметры Пi = wi = fi (xi), совокупности, характеризующие эксплуатационное свойство xΣ;
- определение характеристик состава и технологических показателей процесса получения, косвенно характеризующих эксплуатационные свойства горючего;
- определение суммарных характеристик на основе зависимости wΣ = fΣ (Фм, Фу, Фк, xΣ), из которой при Фм, Фу, Фк = const вычисляют суммарный параметр ПΣ = wΣ = fΣ (xΣ);
- определение характеристик в виде зависимостей между параметрами факторов, учитывающих условия Фу или конструкцию Фк. Их выбирают таким образом, чтобы при измерении в определенных пределах для любого заданного значения фактора Фу или Фк можно было получить такие значения другого фактора Фу или Фк, при которых сохраняется постоянная заданная скорость физико-химического процесса wΣ = const. Конкретные примеры таких характеристик эксплуатационных свойств горючего приведены в статье Состав и характеристики качества горючего“Качество топливо и его основные характеристики”.
В зависимости от условий проведения испытаний и конструктивных особенностей двигателей, стендов, лабораторных приборов и установок все физико-химические характеристики свойств горючего можно разделить на три группы:
1 физико-химические характеристики, представляющие собой константы или некоторые постоянные для заданных условий их определения величины, а также характеристики химического состава горючего. К ним относятся, например:
- плотность, давление насыщенных паров, теплота образования, сгорания и испарения;
- вязкость, поверхностное натяжение, теплопроводность, теплоемкость и температуропроводность;
- температура воспламенения, температура плавления, содержание отдельных компонентов или отдельных групп углеводородов и гетероорганических соединений;
2 физико-химические характеристики, определяемые на лабораторных установках, моделирующих суммарные физико-химические процессы. К ним относятся:
- фракционный состав,
- индукционный период,
- содержание фактических смол,
- испытание на медной пластинке,
- температура начала кристаллизации,
- помутнения и застывания (для сложных смесей),
- термическая и химическая стабильность,
- коррозионность,
- противоизносные свойства и др.:
3 характеристики эксплуатационных свойств, определяемые на установках и стендах, воспроизводящих сложные суммарные процессы, а также на двигателях:
- октановое и Применение горючих газов в качестве топлива в дизельных двигателяхцетановое число,
- характеристики индикаторные – противоизносные,
- склонность к отложениям,
- коррозионные и др.
Следует отметить важность выбора условий испытания и конструкции приборов, установок, стендов и двигателей для оценки эксплуатационных свойств горючего. Каждый сложный физико-химический процесс (подача топлива, испарение, смесеобразование в двигателях, воспламенение и горение, коррозия и др.) протекает по-разному (различается механизмом физико-химических превращений). Поэтому, воспроизводя или моделируя тот или иной процесс, наряду с правильно выбранными условиями проведения испытаний надо подобрать фактор Фм, учитывающий механизм физико-химического процесса.
Значения характеристик, оценивающих уровень эксплуатационных свойств горючего, зависит от условий проведения испытания и конструктивных особенностей энергетических установок, стендов, установок и приборов. Практически не представляется возможным точно воспроизвести в различных технических системах одни и те же условия испытания. Поэтому при оценке эксплуатационных свойств горючего наиболее целесообразен метод топливных эквивалентов – сравнение испытуемого горючего с эталонными. Его можно выполнить на отдельных наиболее характерных режимах испытаний или в определенном интервале изменения характеристик эксплуатационных свойств эталонного и испытуемого горючего. В связи с тем, что с изменением условий испытания характеристики эксплуатационных свойств горючего различного химического состава неодинаковые, во многих случаях следует выбирать несколько эталонов горючего. Для определения уровня эксплуатационных свойств горючего можно использовать различные сочетания характеристик. Важнейшими из них являются характеристики:
- энергетические,
- прокачиваемость,
- испаряемость,
- горючесть,
- стабильность,
- коррозионность и токсичность.
Характеристики задаются тактико-техническими требованиями на разработку новых образцов, указаны в ГОСТах на горючее для судовой техники. Установленные пределы значений технических характеристик обеспечивают необходимый уровень эксплуатационных свойств горючего.
Оптимизация уровня эксплуатационных свойств горючего достигается изменением его химического состава и добавлением присадок.
Универсальных присадок, улучшающих в одинаковой степени различные эксплуатационные свойства всех групп горючего, не существует. Одни и те же компоненты присадок в зависимости от комбинации и концентрации, а также условий применения топлива могут оказывать однофункциональное, многофункциональное действие или даже давать противоположный эффект. Это определяется механизмом того или иного процесса и условиями его протекания. Учитывая сложный характер и взаимное влияние многих физических и химических превращений горючего при хранении, транспортировке и применении, для улучшения эксплуатационных свойств, как правило, необходимо использовать присадки многокомпонентные и многофункционального действия.
Некоторые ингредиенты присадок слабо или совсем не растворяются в горючем и для того, чтобы их ввести в него, необходимо эти ингредиенты растворить в определенном носителе. Носитель нужен также для того, чтобы обеспечить требуемую последовательность действия тех или иных ингредиентов. Это достигается, например, физико-химическим взаимодействием носителя с компонентами присадки и образованием соединений с различной прочностью связей активных элементов между собой и с элементами основы горючего. В определенных стадиях физико-химических превращений эти связи разрушаются и ингредиенты присадок оказывают необходимое действие.