Коррозией называется процесс разрушения материалов различными физико-химическими и биологическими агентами – коррозионной средой. Коррозионность – эксплуатационное свойство горючего – следует относить не только к исходному состоянию горючего, но и к состоянию после известных химических превращений, а также к продуктам сгорания. Углеводороды и их смеси обычно не взаимодействуют с многими основными конструкционными материалами.
Неуглеводородные вещества, продукты химических превращений горючего и некоторые организмы, размножающиеся в нем, способны агрессивно воздействовать на материалы, с которыми они контактируют.
Виды и механизм коррозионных процессов
Вид и характер коррозионных процессов чрезвычайно разнообразны. Это разнообразие определяется не только условиями их протекания, но и особенно зависит от сочетания различных коррозионных сред и материалов. Так, по характеру разрушений для металлов и сплавов различают более 20 видов коррозионных поражений. Они проявляются в виде:
- сплошной равномерной и неравномерной;
- местной;
- питтинговой и подповерхностной;
- межкристаллитной;
- щелевой коррозии.
Для углеводородного горючего при контакте с конструкционными материалами наиболее характерными коррозионными процессами являются:
- для неметаллических материалов – диффузионный и набухание;
- для металлов и сплавов – химический и электрохимический (рис. 1).
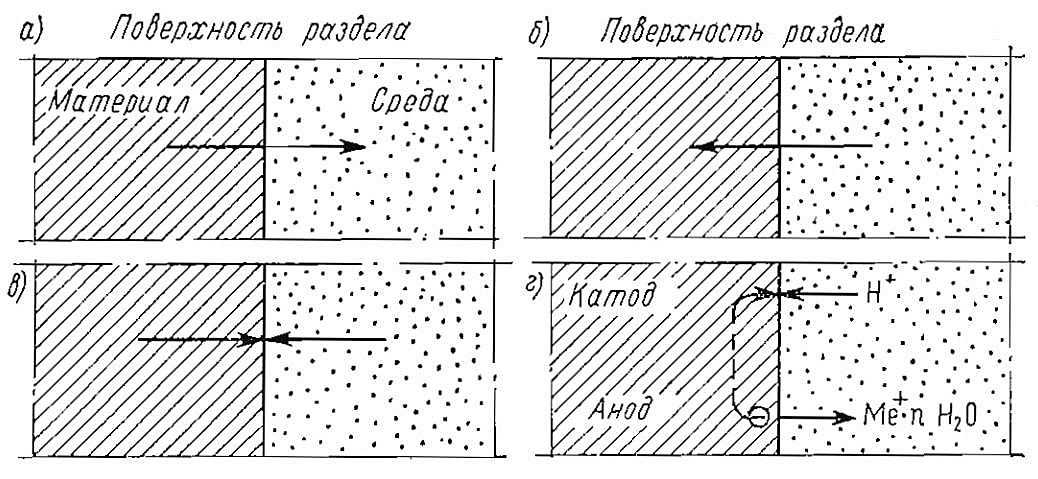
a – диффузионная коррозия; б – набухание; в – химическая коррозия; г – электрохимическая коррозия
При диффузионной коррозии разрушение происходит только за счет односторонней диффузии атомов и молекул коррозирующего материала в коррозионную среду. Набухание – диффузия молекул коррозионной среды в коррозирующий материал. Набухание проявляется в увеличении объема материала и сопровождается изменением его физико-химических свойств. Это процесс в той или иной степени происходит при контакте резиновых изделий (мягких резервуаров и трубопроводов, уплотнительных деталей и др.) с горючим.
К химической коррозии относятся процессы, возникающие при непосредственном химическом взаимодействии между материалом и коррозионной средой и не сопровождающиеся возникновением электрического тока. Химическая газовая коррозия наблюдается при контакте материалов с продуктами сгорания горючего в условиях высоких температур.
Электрохимическая коррозия – наиболее часто встречающийся процесс разрушения металлов и сплавов. Неоднородность материалов или коррозионной среды приводит к возникновению на их поверхности микроскопических коротко замкнутых гальванических элементов. На анодном участке гальванического элемента металл в виде гидратированных ионов переходит в коррозионную среду. Образующиеся при этом избыточные электроны под воздействием разности потенциалов переходят на катодный участок, где ассимилируются ионами или молекулами среды.
Анодный процесс электрохимической коррозии протекает в основном по реакции:
Катодный процесс связывания электронов осуществляется в результате реакции e– + D → De–, где символ D обозначает деполяризатор. Например:
Если ассимиляция избыточных электронов на катоде не происходит, то потенциал его постепенно смещается в сторону отрицательных значений. При протекании электрического тока значение анодного потенциала также может изменяться в положительную сторону и приближаться к потенциалу катода. Когда значения потенциалов катода и анода становятся одинаковыми, гальванический элемент перестает работать.
Изменение потенциала при прохождении тока в процессе работы гальванического элемента называется поляризацией. Это очень важный процесс, регулирующей скорость коррозии. Если бы электродные потенциалы анодных и катодных участков корродирующего металла сохраняли свою первоначальную величину, то разрушение металлов превышало бы действительно наблюдаемое явление в сотни и тысячи раз. Скорость коррозии wкор в общем виде для любого вида разрушений определяется количеством материала Gкр, превращаемого в продукты коррозии с единицы поверхности в единицу времени τ:
Скорость Особенности коррозии в морской и пресной водехимической коррозии зависит от скорости взаимодействия реагирующих веществ и от свойств защитной пленки (слоя продуктов коррозии), сцепленной с поверхностью металла и возникающей в ходе коррозионного процесса. Если защитная пленка создает большое препятствие диффузии атомов и молекул коррозионной среды к поверхности металла и атомов металла через пленку, то скорость коррозии оказывается небольшой и уменьшается по мере роста защитной пленки.
Выражение скорости химической коррозии в зависимости от концентрации агрессивных веществ в коррозионной среде Cа. в, от факторов, определяющих рост толщины пленки dh/dτ, и свойств пленки xпл осуществляется обычно в виде эмпирических формул, полученных на основании обработки экспериментальных данных зависимостей:
Основное аналитическое уравнение для определения скорости электрохимической коррозии имеет вид:
где:
- k – коэффициент пропорциональности;
- Eк – Eа – разность потенциалов катодного и анодного процессов;
- pк, pа – соответственно катодная и анодная поляризуемость;
- R – омическое сопротивление системы.
Электродвижущей силой коррозионных элементов является величина Eк – Eа, пропорциональная уменьшению свободной энергии системы при протекании процесса коррозии. Однако при заданной Eк – Eа скорость коррозии целиком определяется величиной pк + pа + R. Для растворов с заметной электропроводностью значение омического сопротивления мало и скорость коррозии в основном зависит от катодной и анодной поляризуемости.
Факторы, определяющие скорость коррозии
Механизм и скорость коррозии определяются природой корродирующего материала, составом коррозионной среды и условиями протекания процесса. Перечисленные факторы настолько взаимосвязаны, что нельзя судить о скорости коррозии, не относя ее к определенному материалу и условиям. Поэтому коррозиойность горючего более чем любое другое эксплуатационное свойство следует рассматривать и оценивать для определенных условий его проявления в контакте с теми или иными материалами и условиями развития коррозионных процессов.
Основными конструкционными материалами, в контакте с которыми находится горючее, являются металлы и их сплавы. Состояние большинства металлов, используемых для технических целей, в условиях той или иной коррозионной среды термодинамически неустойчиво. Поэтому металлы и сплавы самопроизвольно постепенно переходят в более устойчивое состояние, характеризуемое меньшим энергетическим уровнем. Термодинамическая устойчивость позволяет лишь судить о возможности возникновения и протекания коррозии. Скорость коррозии определяется прежде всего условиями окружающей среды, но изменение среды оказывает большое влияние, и на термодинамическую устойчивость материалов. Например, в средах, содержащих:
- влагу,
- кислород,
- продукты окисления углеводородов,
- некоторые гетероорганические соединения и ряд других веществ,
часто наблюдается сильная коррозия металлов, которые принято считать достаточно термодинамически устойчивыми.
Приближенное суждение о степени термодинамической неустойчивости металлов можно сделать по величине их стандартного электродного потенциала по отношению к нормальному водородному электроду. Металлы с переменной валентностью могут характеризоваться несколькими потенциалами, относящимися к различным электродным реакциям. В табл. 1 для примера приведены величины стандартных электродных потенциалов ряда металлов.
| Таблица 1. Стандартные электродные потенциалы металлов | |||
|---|---|---|---|
| Электродная реакция Me ⇄ Men+ + ne– | Стандартный электродный потенциал E0, B | Электродная реакция Me ⇄ Men+ + ne– | Стандартный электродный потенциал E0, B |
| K-e– | -2,925 | Fe-3e– | -0,440 |
| Ba-e– | -2,900 | Mn-3e– | -0,283 |
| Ca-2e– | -2,870 | Ni-2e– | -0,250 |
| Na-e– | -2,714 | Sn-2e– | -0,136 |
| Mg-2e– | -2,370 | Pb-2e– | -0,126 |
| Al-3e– | -1,660 | Cu-2e– | +0,337 |
| Mn-2e– | -1,180 | Hg-e– | +0,789 |
| Zn-2e– | -0,762 | Ag-e– | +0,799 |
| Cr-3e– | 0,740 | Pt -2e– | +1,190 |
Практически коррозионная устойчивость технических металлов определяется не только их электродным потенциалом, но и реально возможными для них коррозионными процессами. Так, свинец, имеющий небольшие значения стандартного электродного потенциала, является весьма неустойчивым в составе антифрикционных сплавов и легко коррозирует под воздействием органических кислот. Неоднородность структуры металлов, внутренние напряжения, состояние поверхности существенно влияют на протекание коррозионных процессов.
Образование защитных пленок на поверхности металлов и сплавов резко изменяет характер и скорость коррозионных процессов. Чем прочнее и плотнее пленка, образующаяся на поверхности металла, тем меньше скорость коррозии. Эффективность действия таких пленок зависит от многих факторов, с которыми связаны физико-химические свойства пленок и их восстановление после разрушения. Следует отметить такие свойства пленок, как прочность и пластичность, способность удерживаться на поверхности и не разрушаться под воздействием агрессивных компонентов, вызывающих коррозию.
Читайте также: Классификация и основные эксплуатационные свойства горючего
Свойства пленок и скорость их роста зависят от характера агрессивных веществ, входящих в состав коррозионной среды, и компонентов, специально добавляемых к ней с целью понижения скорости коррозии.
В начальных стадиях химической коррозии его скорость определяется скоростью химических превращений при взаимодействии коррозионно-агрессивных продуктов с металлом. В дальнейшем по мере роста защитной пленки скорость коррозии определяется диффузией агрессивных компонентов через пленку.
Главными тормозящими факторами электрохимической коррозии являются катодная pк и анодная pа поляризации. Резкое снижение скорости электрохимической коррозии может быть достигнуто вследствие торможения анодной реакции ионизации металла при образовании на его поверхности фазовых или адсорбционных слоев – пассивации. Активная пассивация осуществляется, например, вследствие образования нерастворимых продуктов коррозии или специальной консервацией какой-либо смазкой. Пассивный металл при изменении внешних условий может снова переходить в активное состояние.
Наиболее важными внешними факторами являются:
- температура,
- давление,
- продолжительность контакта и скорость движения материала и среды относительно друг друга.
Повышение температуры коррозионной среды обычно вызывает ускорение процессов коррозии. Это связано с увеличением константы скорости химических реакций взаимодействия агрессивных компонентов с металлом при отсутствии защитных пленок или малой толщине пленок и с увеличением скорости диффузии активных продуктов через пленку. Характер зависимости wкор = f (T) во многом зависит от того, как влияет температура на структуру пленки и ее свойства.
Влияние давления сказывается в таком же направлении, как и температура, но обычно в значительно меньшей степени. Скорость движения коррозионной среды относительно поверхности металла может влиять на интенсивность химических и электрохимических процессов, ускоряя или замедляя их развитие в результате изменения тепло- и массообмена, а также аэродинамического воздействия на пленку.
В ходе коррозионных процессов изменяются факторы, ускоряющие и замедляющие их развитие. Поэтому в отдельные периоды скорость коррозии не остается постоянной.
Характеристики коррозионности горючего
Коррозионность горючего определяется способностью вызывать коррозию в результате наличия коррозионно-агрессивных соединений:
- органических и неорганических кислот и щелочей;
- соединений серы;
- ванадия и натрия;
- а также способностью вызывать коррозию в результате микробиологического поражения.
Содержание в горючем водорастворимых кислот и щелочей изменяет pH среды и тем самым резко увеличивает ее коррозионную агрессивность по отношению ко многим металлам и сплавам. Органические кислоты, переходящие из нефти в процессе производства и образующиеся вследствие окисления горючего при транспортировке, хранении и применении, вызывают коррозию металлов. Характер этих кислот различен и зависит от состава горючего и условий химических превращений в процессе хранения, транспортировки и применения. Особенности этих процессов были рассмотрены выше.
Низкомолекулярные органические кислоты вступают в реакцию с цветными металлами:
- Pb,
- Cu,
- Ag,
непосредственно и вызывают их коррозионное разрушение.
Высокомолекулярные органические кислоты в присутствии воды и кислорода воздуха способны приводить к коррозионному разрушению в результате ряда последовательных реакций, например:
В горючем могут находиться разнообразные сернистые соединения:
- элементарная сера,
- сероводород,
- меркаптаны,
- сульфиды,
- дисульфиды,
- тиофены,
- теофаны,
- сульфокислоты и др.
Эти соединения взаимодействуют с металлами по разному. Наиболее активны элементарная сера и сероводород. Элементарная сера действует на медь, а при повышенной температуре и на железо. Сернистое железо может постепенно превращаться в губчатую массу, содержащую Fe3S4 и коллоидное железо. В контакте с кислородом воздуха коллоидное железо быстро окисляется с выделением теплоты; это может привести к взрыву смеси паров горючего с воздухом в резервуарах. Сероводород вызывает коррозию:
- меди,
- цинка,
- латуни,
- железа с образованием сульфидов.
Меркаптаны при действии на металлы разрушают их, образуя меркаптиды.
В начальных стадиях взаимодействия горючего, содержащего активные сернистые соединения, с металлом образуется защитная – сульфидная или иная пленка, и коррозия замедляется. Затем защитная пленка разрушается и наблюдается увеличение коррозии. Коррозия металлов не всегда возрастает пропорционально содержанию общей и меркаптановой серы в горючем. В присутствии алифатических меркаптанов до концентрации в расчете на серу менее 0,01 % коррозия растет незначительно. При дальнейшем увеличении меркаптановой серы коррозия резко возрастает. Введение ароматических меркаптанов значительно увеличивает коррозию при концентрации, превышающей 0,0005 %. Наибольшей коррозионной активностью обладают меркаптаны с одним ароматическим кольцом и SH-группой, присоединенной к кольцу. Сульфиды, дисульфиды, тиофаны не взаимодействуют непосредственно с металлами. Однако в случае повышенных температур термодеструктивные превращения сернистых соединений сопровождаются образованием более активных продуктов, вызывающих коррозию металлов.
При сгорании все сернистые продукты образуют окислы SO2 и SO3, от действия которых в зависимости от условий возникает газовая или кислотная коррозия. При высоких температурах SO2 и SO3 взаимодействуют с металлами – появляется газовая коррозия. С понижением температуры среды коррозия переходит в атмосферную (так называют коррозию в среде любого влажного газа). Поскольку SO3 образует при этом H2SO4 – более агрессивную кислоту, чем SO2 + H2O → H2SO3, на величину коррозии продуктов сгорания сернистого горючего влияет соотношение между SO2 и SO3. Это соотношение зависит от состава горючей смеси, давления и температуры.
Точка росы с повышением содержания в газе SO3 возрастает, что увеличивает опасность Характеристики топлива для судовых дизелейкоррозии в двигателе. Температура кипения смеси H2O + H2SO4 определяется соотношением компонентов, причем точка росы в соответствии с законом фазового равновесия выше, чем температура кипения. Температура конденсации зависит от парциального давления пара и является функцией состояния газа.
Изменение состояния системы H2O + H2SO4 при изменении температуры показано на рис. 2.
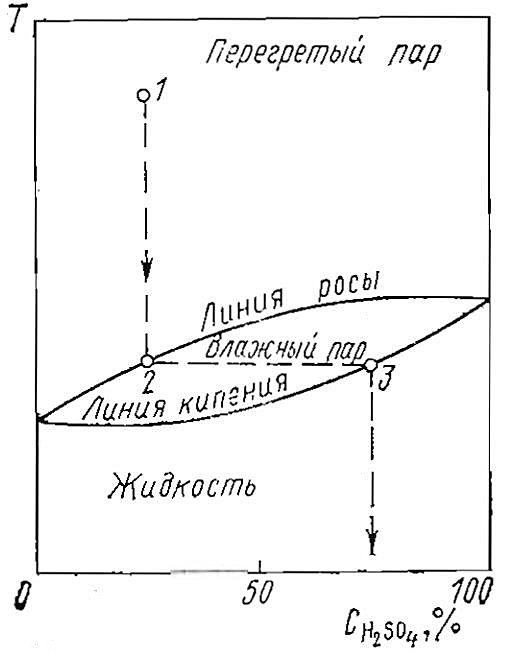
Пар с небольшим содержанием H2SO4 (точка 1) охлаждается, не изменяя состава до точки росы (точка 2). Затем пар становится насыщенным и образует капли, которые обогащаются серной кислотой до тех пор, пока содержание ее в каплях не достигнет предела, соответствующего температуре кипения данной смеси (точка 3). Присутствие в тяжелом горючем соединений натрия и ванадия, так же как и соединений серы, определяет его склонность к отложениям и коррозионность. Температура плавления некоторых соединений ванадия, натрия, серы сравнительно низкая, около 650 °C. Расплавленные частицы при соприкосновении с поверхностью, температура которой ниже температуры их плавления, затвердевают. При температуре поверхности выше 500 °C некоторые соединения ванадия, натрия, серы, находящиеся в газовом потоке, отлагаются на поверхности в жидкой или полужидкой фазе.
Жидкие соединения золы проникают в металл вдоль границы зерна, разрушая металл. Расплавленный слой зольных отложений продолжает поглощать кислород из окружающих газов. Это, кислород способствует быстрому окислению металла под слоем отложений.
Механизм ванадиевой коррозии заключается, видимо, в том, что окислы ванадия и ее соединения с натрием являются переносчиками кислорода и ускоряют окисление металлов. При контакте железа с пятиокисью ванадия в среде газа, содержащего кислород, возможны следующие реакции:
Пятиокись ванадия оказывает сильное действие на процессы окисления и разрушения металла, если она находится в расплавленном или размягченном состоянии. В жидком состоянии она растворяет окисную пленку на поверхности металла. В процессе растворения, протекающего одновременно с окислительно-восстановительными реакциями, из раствора выделяются ванадаты, реагирующие с металлом.
В обводненном горючем скорость коррозии возрастает и особенно в случае выделения воды в виде отдельной фазы. В воде накапливаются агрессивные вещества. Это способствует окислению металлов, так как реакции взаимодействия слабых органических кислот с окислами металлов протекают значительно быстрее, чем с металлом. Вода может растворять некоторые продукты коррозии и тем препятствовать образованию защитных пленок на поверхности металла. Вода является также необходимым условием жизнедеятельности микроорганизмов, с чем также связана коррозия.
Микроорганизмы наиболее легко поражают среднедистиллятные фракции топлива. Бензин оказывает определенное токсическое действие на микроорганизмы, однако они могут развиваться и в нем. Микроорганизмы могут быть причиной эмульгирования горючего и воды. Под действием микроорганизмов увеличивается кислотность горючего, содержание в нем смол и непредельных соединений. В обезвоженном горючем микроорганизмы не размножаются, но могут оставаться жизнеспособными очень долгое время и при попадании воды снова развиваться. Обильный рост наблюдается на границе раздела фаз вода — горючее. В присутствии микроорганизмов усиливается электрохимическая коррозия в результате увеличения аэрации и концентрации кислорода на определенных участках металлической поверхности, где находится микробный нарост, катодной деполяризации, вызванной действием микроорганизмов, разрушений предохранительных покрытий и разложения ингибиторов электрохимической коррозии.
В процессе жизнедеятельности микроорганизмов образуются различные агрессивные, продукты:
- минеральные и органические кислоты,
- аммиак,
- сера,
- углекислота и др.
Побочными продуктами азотистого обмена микроорганизмов являются азотистая и азотная кислоты. Распространенные в нефтепродуктах сульфатовосстанавливающие бактерии вызывают восстановление сульфатов различных металлов, присутствующих в водной фазе, до элементарной серы и сероводорода. Под действием сульфатовосстанавливающих бактерий, находящихся в водной фазе, сульфатионы восстанавливаются в ионы серы, которые, взаимодействуя с ионами железа, образуют сульфид, что приводит к разрушению металла.
Возможные реакции, протекающие при микробиологической коррозии:
- 8H2O → 8OH– + 8H+;
- 4Fe → 4Fe2+ + 8e– (анод);
- 8H+ + 8e– → 4H2 (катод);
- (катодная деполяризация);
- Fe2+ + S2- → FeS (анод);
- 3Fe2+ + 60H– → 3Fe(OH)3 (анод).
Водород, образующийся в результате электрохимических процессов (реакции 1, 3), скапливается на поверхности железа и используется сульфатовосстанавливающими бактериями.
Микроорганизмы способны разрушать защитные пленки, при этом обнажается поверхность металлов и интенсифицируется электрохимическая и микробиологическая коррозия.
Присадки для снижения коррозионной агрессивности горючего
Для снижения коррозионности топлива выбирают присадки в зависимости от механизма коррозионного процесса. С целью нейтрализации коррозионного действия на топливную аппаратуру сернистых топлив при повышенных температурах используют присадки, предотвращающие образование агрессивных продуктов окисления углеводородов и сернистых соединений (сульфокислоты и серная кислота). Такими качествами обладают присадки для повышения термической стабильности – амины, сера-азотсодержащие соединения – аминосульфиды и полимерные диспергенты. Противоизносными свойствами при повышенных температурах могут обладать:
- антиокислители,
- деактиваторы металлов,
- поверхностно-активные защитные присадки.
Электрохимическая Коррозионность горючего в судовых дизеляхкоррозия топлив в присутствии влаги может быть уменьшена добавкой в топливо:
- аминов,
- фосфорных соединений,
- солей нафтеновых и сульфокислот,
- фенолов,
- нитрованных масел.
Защитное действие таких присадок объясняется поверхностной активностью, образованием адсорбционной пленки на поверхностях металлов, а также пассивацией этих поверхностей в результате образования хемосорбционных Покрытия с повышенной гидрофобностью для защиты от обледенениягидрофобных пленок. Присадки сульфонатного типа обладают высокой защитной эффективностью в сернистых дизельных топливах. В табл. 2 приведены некоторые зарубежные противокоррозионные присадки и их состав.
| Таблица 2. Некоторые зарубежные противокоррозионные присадки | |||
|---|---|---|---|
| Наименование | Фирма | Состав | Концентрация |
| Ethyl MPA | “Ethyl Corp.” | Смесь замещенных жирных аминов | Многофункциональная |
| Nalko 160T | “National Aluminate” | Азотосодержащее поверхностно-активное соединение | Рекомендуемая концентрация 0,0005-0,004 % |
| Du Pont RP-2M (ДМА-4) | “Du Pont” | Растворитель (20 %), аминоалкилфосфаты (разветвленные) C7-C14 (50 %), октиламины (25 %), растворитель (25 %) | Применяют и как противообледенительную |
| Lubrizol 541 | “Lubrizol Corp.” | Беззольные полярные соединения | – |
| Gulf Agent-178 | Алкиломинофосфаты | 16-56 мг/л | |
| Nasul LP | Этилендиаминдинонил-нафталинсульфофонат (50 %-ный раствор) | 48-56 мг/л | |
| Du Pont RP-2 | “Du Pont” | Октиловые эфиры фосфорной кислоты (25 %), октиламины и октиловые спирты (55 %), растворитель (20 %) | 20-56 мг/л |
Наибольшее распространение в качестве присадок, предотвращающих ванадиевую коррозию, получили соединения магния и алюминия. Достаточно эффективны также соединения цинка.
Большинство рекомендованных соединений в топливе нерастворимы. Поэтому присадки, предотвращающие ванадиевую коррозию, применяют в виде суспензии или коллоидной дисперсии в масле, либо в виде водного раствора, подаваемого в зону сгорания, либо в виде тонко распыленных твердых частиц, вводимых непосредственно в пламя топки парового котла.
В качестве присадки для борьбы с ванадиевой коррозией фирма «Dow Chemical Company» производит гидроокись магния Mg(OH)2 и гидроокись алюминия Al(OH)3 в виде коллоидной дисперсии в масле (табл. 3).
| Таблица 3. Состав и свойства коллоидных дисперсий гидроокисей магния и алюминия в масле | |||||||
|---|---|---|---|---|---|---|---|
| Активный компонент присадки | Содержание % | Размер частиц, мкм | Плотность, при 25 °C, г/см3 | Вязкость при 25 °C, сПз | |||
| активного компонента | воды | масла | средний | 95 % всех частиц | |||
| Mg(OH)2 | 57 | – | – | 0,48 | 1,05 99 % частицx | 1,372 | 3 850 |
| Mg(OH)2 | 43,2 | 18,3 | 38,5 | 0,28 | 1,20 | – | 9 500 |
| Al(OH)3 | 51,0 | 7,8 | 41,2 | 0,5 | 1,5 | 1,51 | 5 500 |
В топливо, содержащее 0,0002 % и меньше ванадия, присадки, как правило, не добавляют.
В четырехтактных среднеоборотных дизелях, а также в двухтактных с прямоточно-клапанной продувкой успешно применяют присадки к тяжелому топливу, предотвращающие образование на них зольных отложений, состоящих из соединений ванадия и натрия. Присадки представляют собой растворимые в топливе соединения кремния. При сгорании они образуют SiO2, которая, входя в состав золы, повышает ее температуру плавления и способствует выносу зольных элементов из камер сгорания двигателя.
Для предупреждения ванадиевой коррозии в качестве присадок испытывались:
- окись магния,
- окись цинка,
- окись алюминия,
- окись кремния,
- а также соединения кремния, например, в виде кизельгура или диатомистой земли.
Присадки, содержащие кремний, устраняют также образование отложений.
