По определению IMO газ — это «продукт, имеющий абсолютное давление более 2,8 бар при температуре 37,8 °С».
На газовозах перевозят самые разные газы — как состоящие из молекул, в состав которых входят только углерод и водород (углеводороды), так и из молекул отдельных элементов (хлор) или из молекул, имеющих более сложный состав (аммиак, эпоксиды). За исключением аммиака и хлора все эти продукты, в основном, транспортируют на газовозах типа «LPG».
Химические свойства газов
Остановимся подробнее на отдельных группах газообразных соединений и их свойствах.
Алканы. Алканы представляют собой самую простую группу органических соединений, молекулы которых состоят только из углерода и водорода. Это насыщенные углеводороды (гидрокарбонаты), их названия оканчиваются суффиксом «ан».
Структура алканов — углеродные цепи, не содержащие кратных (двойных, тройных) связей между атомами углерода или циклов. Низшие алканы — метан (CH4), этан (C2H6), пропан (C3H8), бутан (C4H10). Четыре перечисленных алкана при нормальных условиях являются газами, в то время как более высокие — пентан, гексан и т. д. — жидкостями. Алканы выше пентадекана (C15H32) представляют собой твердые воскообразные вещества.
Алканы — нейтральные соединения, нерастворимые в воде и некоторых органических растворителях. Они представляют собой относительно Инертизация, продувка воздухом и замена груза в грузовых танкахинертные вещества, для которых характерно небольшое количество простых реакций. При нагревании до достаточно высокой температуры алканы сгорают в воздухе или кислороде с образованием воды и двуокиси углерода. При недостатке кислорода продуктом процесса горения может быть окись углерода или чистый углерод. Здесь же целесообразно упомянуть и о циклоалканах.
Циклоалканы — это насыщенные углеводороды, углеродный скелет которых имеет форму кольца, а не открытой цепи. Такого вида вещества используются в качестве анестезирующих средств. Их существенным недостатком является легкая воспламеняемость. Общая формула алканов — CnH2n+2. Если из молекулы алкана удален атом водорода, образуется свободный радикал.
Большинство молекул алканов, содержащие более трех атомов углерода (бутан, пентан и выше), могут иметь строение не только в виде прямой цепи, но и в виде цепи с ответвлениями. Соединения, имеющие одинаковую молекулярную формулу, но разное строение молекул, называются изомерами. Изомеры обычно имеют более низкие значения температуры кипения и плавления, чем прямолинейные алканы.
Многие алканы, имеющие как простое, так и разветвленное строение, встречаются в нефти и природном газе.
Алкены. Алкены (олефины) — это молекулы углеводородов, в которых атомы углерода соединены между собой двойными связями. Алкены представляют собой ненасыщенные соединения, их названия оканчиваются суффиксом «ен». Двойная связь между атомами углерода слабее, чем обычная одинарная. Это означает, что молекулы алкенов менее стабильны (менее устойчивы). Соединения с одной двойной связью C = C называются непосредственно алкенами, с двумя — алкадиенами. На газовозах могут транспортироваться следующие алкадиены: 1,2 – бутадиен C4H6 (Methylallene) с температурой кипения 10,85 °С; 1,3 – бутадиен C4H6 (Bivinyl) с температурой кипения – 4,41 °С.
Как уже упоминалось, в этих соединениях существуют ненасыщенные связи (C = C), которые стремятся к насыщению. Часто молекулы алкенов называют мономерами. При определенных условиях мономеры способны объединяться, образуя при этом длинные цепи. Для начала этого процесса требуется небольшое количество инициатора (перекиси), который вызывает образование свободных радикалов. Свободные радикалы присоединяются к молекулам мономеров, образуя при этом новые радикалы, которые присоединяют следующие мономеры и т. д.
Такой процесс называется полимеризацией. В результате процесса полимеризации из мономеров образуются соединения с очень длинными молекулами — полимеры, которые по своим свойствам отличаются от исходного вещества. Для предотвращения полимеризации при перевозке мономеров чаще всего применяют ингибирование – то есть добавление вещества, препятствующего инициации процесса полимеризации. Такие вещества называют ингибиторами. Еще одним способом предотвращения полимеризации газов-мономеров является постоянное охлаждение груза.
Предлагается к прочтению: Грузовое устройство нефтяного танкера
Галогеновые углеводороды. Эти вещества получаются в том случае, когда в алканах или алкенах один или несколько атомов водорода замещены атомами галогенов — например, атомами хлора или брома. Такие соединения имеют свойства, делающие их более удобными при перевозках. Многие из этих веществ представляют собой газы или летучие жидкости и хорошо соответствуют условиям транспортировки в газовозах. В качестве примера можно упомянуть следующие галогенуглеводороды: метил-бромид CH3Br с температурой кипения 3,5 °С; этил-хлорид C2H5Cl с температурой кипения 12,5 °С; винил-хлорид C2H3Cl; монохлорэтин CH2CHCl с температурой кипения -13,9 °С.
Альдегиды. В перечне «IGC Code» указан только один продукт, относящийся к классу альдегидов. Это ацетилдегид CH3CHO с температурой кипения 20,2 °С.
Эпоксиды. Эпоксиды, или окиси алкенов, представляют собой сложные органические соединения, в состав которых входит трехчленное кольцо. Эти соединения очень реактивны, транспортируют их в общих закрытых системах с инертной средой (азотом). В качестве примера можно привести следующие газы, относящиеся к классу эпоксидов: этилен-оксид C2H4O с температурой кипения 10,7 °С; пропилен-оксид C3H6O с температурой кипения 33,9 °С.
Основные параметры газов
Термодинамические единицы. Каждая шкала единиц (например, для температуры или давления) имеет начальную, или нулевую, точку. Эту точку нередко устанавливают в соответствии со значением абсолютного предела, ниже которого тот или иной параметр просто не существует. Примером могут служить абсолютная температурная шкала в градусах Кельвина, начальной точкой которой является абсолютный ноль температур, или шкала абсолютного давления, в которой отсчет начинается с вакуума. Однако на многих термодинамических диаграммах, например энтальпийных, используют произвольно выбранные нулевые точки. Эти точки и используют для расчетов.
Читайте также: Подготовка морского газовоза к погрузке груза
На рис. 1 приведен пример диаграммы, показывающей зависимость параметров от температуры для n-бутана.
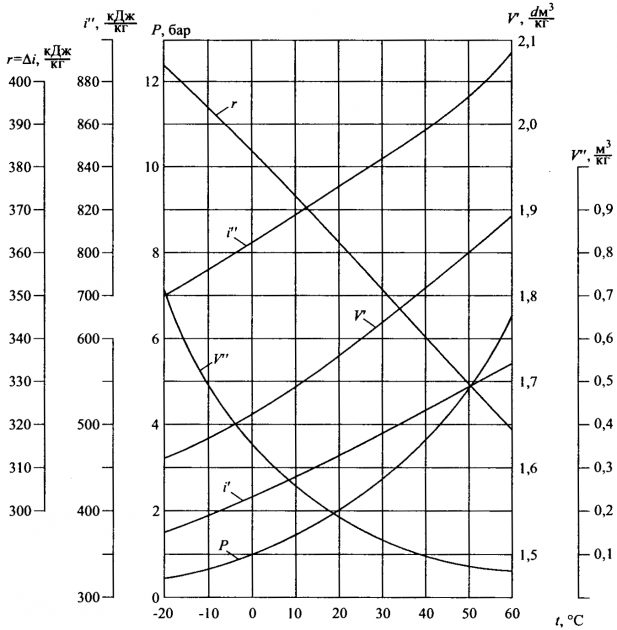
На этом рисунке построены графики, отображающие зависимость от температуры следующих параметров:
- V′, V″ — удельных объемов жидкости (′) и пара (″) при температуре насыщения;
- P — давления насыщения;
- t — температуры насыщения;
- i′ i″ — энтальпий жидкости (′) и пара (″) при температуре насыщения;
- r — скрытой теплоты парообразования.
Температура. Чаще всего используют две наиболее важные температурные шкалы: шкалу Цельсия и шкалу Фаренгейта.
Шкапа Цельсия — стоградусная. За нулевую точку в ней принята температура замерзания воды 0 °С, а 100 °С — это температура кипения воды. Иными словами, диапазон между этими двумя температурными уровнями разделен на 100 градусов. Единица измерения здесь: градус Цельсия (°С).
На шкале Фаренгейта температуре замерзания воды соответствует точка 32 °F, а температуре ее кипения соответствуют 212 °F. Следовательно, участок шкалы между этими значениями температур разделен на 180 градусов. Единица измерения здесь: градус Фаренгейта (°F).
Справедливо следующее утверждение: 0 °С = 32 °F и 100 °С = 212 °F.
Формулы связи между величинами градусов этих двух шкал таковы:
- °F = 9/5 · °С + 32;
- °C = (°F – 32) · 5/9.
Эти соотношения равно справедливы для значений температур выше и ниже температур замерзания воды. Однако, если значение температуры ниже 0 °С, то перед ним следует ставить знак «-».
Помимо температурных шкал Цельсия и Фаренгейта существуют и другие температурные шкалы.
Абсолютным нижним предельным значением температуры, при котором внутренняя энергия всех веществ равна нулю, является абсолютный нуль на абсолютной температурной шкале Кельвина. Этот абсолютный нуль по Кельвину равен -273,1 °С или -459,6 °F. Единица измерения этой шкалы — градус Кельвина (°К).
Абсолютная температурная шкала, в которой используются единицы из шкалы Фаренгейта, известна как шкала Ренкина. Единицы измерения в ней — градусы Ренкина (°R).
Можно записать общее соотношение для нулевой точки во всех четырех шкалах:
- 0°K = 0 °R = -273,1 °С = -459,6 °F.
Очевидно, что перейти от одной температурной шкалы к другой очень просто. Например, для перехода от шкалы Цельсия к шкале Кельвина следует произвести простейшее вычисление:
- °K = °С + 273,1.
Не сложнее будет осуществить и переход от шкалы Ренкина к шкале Фаренгейта:
- °F = °R + 459,6.
В большинстве термодинамических таблиц, диаграмм и расчетов используют абсолютную температуру в градусах Кельвина. В системе СИ используется температура в градусах Цельсия или градусах Кельвина.
Давление. Вспомогательные системы судна-газовоза рефрижераторного типаДавление — это сила, воздействующая на единицу площади поверхности. Основная единица измерения давления — Н/м2 (ньютон на метр квадратный или Паскаль — Па). Однако эта единица измерения на судах используется редко.
Существуют и другие единицы измерения давления. В их число входят: бар, пси (psi), атмосфера физическая, атмосфера техническая, миллиметры ртутного столба (мм рт. ст.) и миллиметры водяного столба (мм вод. ст.). Техническая атмосфера (ат) — это давление величиной 1 кг/см2 , что составляет также 735,5 мм рт. ст. Физическая атмосфера (атм) — это давление величиной 760 мм рт. ст. Пси (psi) — это давление, выраженное в фунтах на квадратный дюйм (lbs/in2).
Давление, величина которого выше атмосферного, и которое измеряют манометром, называется манометрическим (или избыточным). Иными словами нулевой точкой для шкалы измерения манометрического давления является нормальное атмосферное давление. Сумма манометрического и атмосферного давления представляет собой абсолютное давление. Нулевая точка шкалы измерения абсолютного давления — это Физические свойства СПГ, подготовка к перевозке моремдавление любого вещества при абсолютном нуле температуры, т. е. в ситуации абсолютного вакуума. В большинстве температурных шкал, таблиц, диаграмм и расчетов используют именно абсолютное давление.
Ниже представлены переводные коэффициенты для различных единиц измерения давления (табл. 1).
Давление паров. Известно, что над поверхностью жидкости присутствуют ее пары, находящиеся в динамическом равновесии с ней. Равновесие в данном случае означает, что количество молекул, испаряющихся с поверхности жидкости, равно количеству молекул, возвращающихся в жидкость.
Пары, находящиеся в равновесии с жидкостью, имеют давление, которое называется давлением насыщения. Величина этого давления не зависит от возможного присутствия других газов. В присутствии других газов образование паров может происходить более медленно. Однако давление этих других газов не может превышать давления паров над поверхностью жидкости. Давление насыщенных паров зависит от температуры жидкости. Для чистых веществ (не смесей) величину этого давления всегда можно определить по таблице или графику.
Давление паров в смеси. Величина давления насыщенного пара смеси сжиженных газов (таких как сжиженные нефтяные газы) отличается от величин давлений паров отдельных компонентов этой смеси. Используя закон Дальтона и основное уравнение газового состояния, можно определить величину общего давления паров. Давление паров одного из компонентов смеси, которое этот компонент имел бы, если бы над поверхностью смеси находились только его пары называется парциальным.
Для дальнейших объяснений необходимо дать определение мольной доли компонента. Мольная доля — это отношение числа молей одного компонента к общему числу молей всех компонентов смеси. Идеальные смеси подчиняются первому закону Рауля. В соответствии с ним Максимальная интенсивность налива груза в танк газовозапарциальные давления паров компонентов смеси над жидкостью пропорциональны их мольным долям в жидкой фазе:
где:
- PA парц , PB парц — парциальные давления паров компонентов A и B в смеси;
- PA, PB — давления насыщения чистых компонентов A и B при температуре смеси;
- Xa, Xb — мольные доли компонентов A и B.
Мольные доли компонентов рассчитывают по следующим формулам:
где:
- a, b — массовые доли компонентов A и B в жидкой фазе;
- μА, μB — молекулярные массы компонентов A и B.
Процентное содержание (мольная доля) каждого компонента в смеси может быть различным. Рассчитывают мольный фракционный состав смеси в зависимости от весовых долей индивидуальных компонентов.
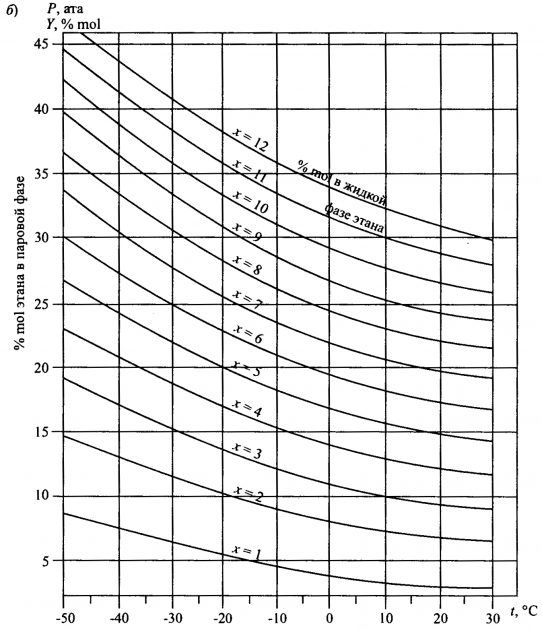
На рис. 2, а и 2, б изображены диаграммы, показывающие зависимость Монтаж вспомогательных паровых машин и паровых насосовдавления паров от температуры. На рис. 2, а представлена зависимость давления паров от температуры при различных концентрациях смесей пропана и этана; на рис. 2, б показана эта зависимость при различных фазовых состояниях этана.
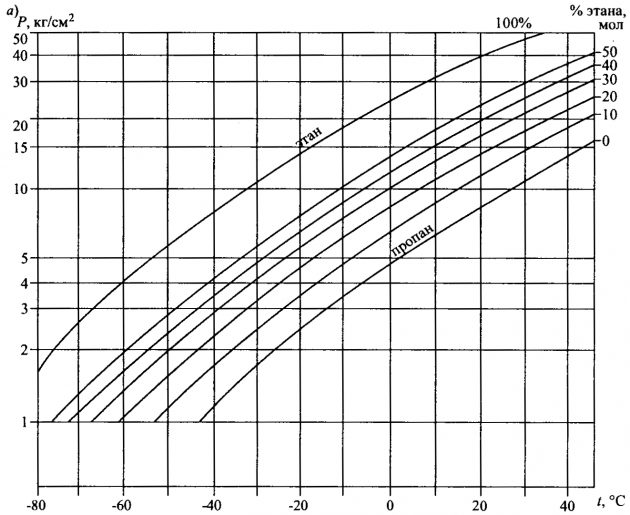
Пример. Предположим, что существует смесь сжиженных нефтяных газов при температуре -40 °С. Состав этой смеси, а также некоторые из ее параметров приведены в таблице 2.
В данной таблице использованы следующие обозначения:
- M (%) — процентное содержание молей компонента в жидкости;
- Pi (ат) — давление насыщения одного чистого компонента при температуре -40 °С;
- Pi см (ат) — парциальное давление компонента при температуре -40 °С;
- Vi (%) — процентное содержание компонента в парах.
Все значения M заданы для данной смеси. Значения Pi определяют по соответствующему графику (подобному тому, который представлен на рис. 2, б).
Значения парциальных давлений Pi см вычисляют по уже известному уравнению:
Процентное содержание компонента в парах Vi определяют при помощи следующего выражения:
Общее давление паров смеси при температуре -40 °С равно сумме значений парциальных давлений компонентов: 1,288.
Это интересно: Ремонт паровых и газовых турбин в рыбной промышленности
Значения всех параметров компонентов для каждой конкретной смеси — величины постоянные, поэтому понятно, почему низкокипящая фракция сохраняется в жидкой фазе даже при температурах, превышающих температуру насыщения чистого газа.
Из рассмотренного примера следует, однако, что небольшое количество низкокипящей фракции может значительно увеличивать давление паров в танке. Иначе говоря, концентрация низкокипящего компонента в паровой фазе будет значительно выше, чем в жидкой фазе.
Точка кипения. Точкой кипения называют температуру, при которой давление паров жидкости равно давлению атмосферы на ее поверхность. Эта температура зависит от величины атмосферного давления. Точка кипения при атмосферном давлении называется нормальной точкой кипения.
Плотность. Плотность определяют как отношение массы газа к его объему. Газы имеют относительно высокий коэффициент объемного расширения. Его величину необходимо учитывать для различных значений температуры, т. е. вводить соответствующую температурную поправку. В системе СИ плотность измеряется в кг/м3 при 15 °С для сжиженных нефтяных газов или при 20 °С для большинства остальных газов.
Относительная плотность (за рубежом принято понятие «удельный вес») есть отношение веса объема вещества при температуре T1 к весу равного объема пресной воды при температуре T2. При этом значение T1 не обязательно равно значению T2. Следует различать разницу между весом в вакууме и весом в воздухе. «Вес» в вакууме равен массе и представляет собой произведение объема на плотность вещества. «Вес» в воздухе — это произведение объема вещества на разность между плотностью вещества и плотностью воздуха (1,1 кг/м3).
В соответствии с законом Авогадро один моль идеального газа при температуре 0 °С и давлении 1 атм занимает объем 22,414 л. Исходя из этого, можно рассчитать плотность газов, близких к идеальным, при этих же условиях (температуре 0 °С и давлении 1 атм). Плотность таких газов в этом случае будет представлять собой отношение молекулярной массы газа к числу 22,414. Для газов, которые не могут быть приняты за идеальные, плотность можно определить по специальным таблицам или диаграммам.
Соотношение плотности газов и плотности воздуха подлежит контролю в целях обеспечения безопасности, поскольку проявляют себя процессы растворения и диссипации газов. Среди обычных природных газов только аммиак имеет плотность меньше, чем плотность воздуха.
Параметры безопасности
Степень пожароопасности и, токсичности (ядовитые свойства) газов можно оценить, исходя из их постоянных параметров. При этом необходимо располагать следующими сведениями:
- количество газа, испаряющегося из продукта;
- пожароопасные свойства, присущие данному газу;
- свойства данного продукта, опасные для здоровья человека.
Давление паров и точка кипения газа являются очень важным параметрами. Однако фундаментальными и наиболее важными параметрами являются следующие:
- температура вспышки;
- границы взрываемости;
- температура самовоспламенения;
- пороговая предельная концентрация (параметр TLV).
Температура вспышки. Это есть самое нижнее значение температуры, при котором выделяется или испаряется количество паров продукта, достаточное для образования воспламеняющейся смеси с воздухом (вблизи поверхности жидкости при наличии огня).
Эту температуру определяют лабораторным способом, с применением специальной установки. При определении температуры вспышки могут быть использованы два метода: метод закрытого тигля и метод открытого тигля. Результаты, полученные при использовании метода открытого тигля, оказываются, как правило, на 5 °С выше, чем при использовании метода закрытого тигля.
Температуру вспышки используют для целей классификации нефтепродуктов. Простая классификация по воспламеняемости используется в ICS (International Chamber of Shipping) и OCIMF (Oil Companies International Marine Forum).
В соответствии с ней все вещества разделяют на две группы:
- Быстроиспаряющиеся летучие вещества с температурой вспышки ниже 60 °С (140 °F). К ним относят в частности газойл, ракетные топлива и сырую необработанную нефть;
- Неиспаряющиеся продукты, температура вспышки которых выше 60 °С (140 °F). В их число входят, например, дизельные топлива, смазочные масла.
Очевидно, что невоспламеняющиеся продукты не имеют температуры вспышки.
В США действует следующая классификация воспламеняющихся веществ:
- Категория А — воспламеняющиеся жидкости с давлением паров 0,965 бар (14 psi) и выше;
- Категория В — воспламеняющиеся жидкости с давлением паров выше 0,586 бар (8,5 psi), но ниже 0,965 бар (14 psi);
- Категория С — воспламеняющиеся жидкости с давлением паров менее 0,586 бар (8,5 psi) и температурой вспышки до 80 °F;
- Категория D — воспламеняющиеся жидкости с температурой вспышки выше 80 °F, но ниже 150 °F;
- Категория Е — воспламеняющиеся жидкости с температурой вспышки выше 150 °F.
Внимание! Все продукты, перевозимые на газовозах, являются летучими и относятся к категории А. При их транспортировке необходимо предпринимать самые серьезные меры предосторожности и меры обеспечения безопасности!
Границы взрываемости. Контролируемый газоотвод на морских танкерахСмесь газов и воздуха не воспламеняется и не горит, если ее концентрация лежит вне границ определенного диапазона. Эти граничные концентрации определяют как границы зоны взрываемости или границы зоны воспламеняемости.
Нижний предел (нижняя граница) этой зоны известен как LFL (Lower Flammable Limit — нижний предел воспламеняемости). Этот предел представляет собой такое значение концентрации газа, ниже которого концентрации газа недостаточно для поддержания и распространения горения. Иными словами, если концентрация газа в смеси с воздухом ниже этого граничного значения, то смесь слишком бедна для поддержания горения.
Верхний предел (верхняя граница) этой зоны известен как UEL (Upper Explosive Limit — верхний предел взрываемости). Он представляет собой такое значение концентрации газа, выше которой концентрация воздуха становится недостаточной для поддержания и распространения горения. То есть, если концентрация газа в смеси с воздухом выше этого предельного значения, то смесь слишком богата для поддержания горения.
Предельные (граничные) значения задают в процентном содержании газа в «нормальном» воздухе, содержащем 21 % кислорода. При пониженном содержании кислорода в воздухе взрывоопасная зона уменьшается; при содержании кислорода в воздухе ниже 11 % углеводородные газы не горят. На рис. 3 показана зона взрываемости для пропана (заштрихованный участок).
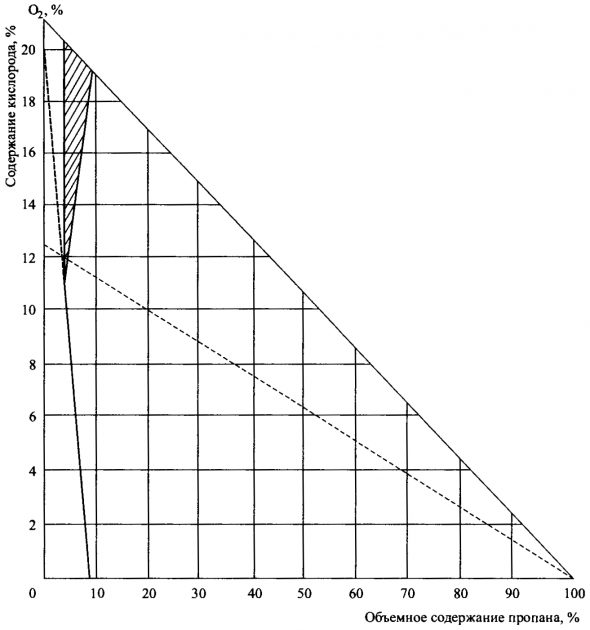
В интересах безопасности необходимо следить за тем, чтобы Безопасность и эксплуатация морских газовозовсостав атмосферы в танке лежал вне пределов концентраций, ограниченных этой зоной. Прежде чем выполнять какие-либо зачистные операции, следует определить состав атмосферы в танке.
Рассмотрим в качестве примера случай для пропана в смеси «воздух — азот» (рис. 3). Если состав атмосферы в танке таков, что его соответствующее значение на графике будет расположено слева от пунктирной линии, проведенной вдоль оси ординат из точки 0,21, то зачистку в танке можно производить атмосферным воздухом. Если же точка, соответствующая составу атмосферы в танке, окажется справа от этой пунктирной линии, то зачистку танка нужно будет проводить только с применением инертного газа или азота. При этом зачистку нужно будет продолжать до тех пор, пока значения, соответствующие концентрации газа и воздуха в танке, не окажутся на графике слева от пунктирной линии. По этой причине, планируя операции по зачистке танков, следует проконтролировать состав атмосферы в танке. Атмосфера в танке всегда должна находиться под контролем и отвечать условиям, определенным с использованием специальных диаграмм.
Температура самовоспламенения. Это температура, при которой газ возгорается в отсутствие внешнего источника огня (воспламенения). Другими словами, это температура, при которой топливо или газ воспламеняются самопроизвольно. Связи между температурой вспышки и температурой самовоспламенения не существует. Температура самовоспламенения не зависит от летучести и испаряемости вещества. В некоторых случаях нелетучие топлива самовоспламеняются легче, чем летучие.
Пороговая предельная концентрация (TLV). Это предельная величина газовоздушной концентрации паров, тумана или брызг продукта, при которой периодическое воздействие продукта на членов экипажа (в течение восьмичасового дня и сорокачасовой рабочей недели) не наносит вреда их здоровью.
Читайте также: Биосфера океанов и развитие промышленной марикультуры
Поскольку диапазон индивидуальной чувствительности людей очень широк, некоторые индивидуумы могут испытывать существенный дискомфорт (болезненные ощущения, плохое самочувствие) при значениях концентрации продукта в воздухе даже ниже TLV. Единица измерения параметра TLV — ppm (parts per million — частиц на миллион). Для каждого газа существует свое значение ppm. Например, для пропана это 1 000, а для винилхлорида — 1. В некоторых случаях и для определенных газов допустимо кратковременное превышение концентрации, если известна ее предельная опасная величина.
В справочниках можно найти для некоторых газов пороговые значения (TLV) по запаху. Пороговые значения по запаху представляют собой минимальные концентрации (измеряемые в ppm), которые большинство людей могут ощутить при помощи собственных органов обоняния. Пороговое значение по запаху — не абсолютная величина, что очевидно. Во-первых, концентрация, соответствующая пороговому значению по запаху, зависит от индивидуальных обонятельных свойств человека; во-вторых, у одного и того же человека чувствительность органов обоняния может меняться день ото дня и даже в течение одного дня.
Следует отметить, что запах потенциально опасного газа может быть скрыт другими запахами. Кроме того, пары некоторых газов вызывают т. н. обонятельную усталость или привыкание, снижая индивидуальную чувствительность по отношению к конкретному запаху. Некоторые люди, например, могут по запаху ощущать присутствие сульфида водорода при его концентрации 1 ppm; другие не ощущают присутствия этого газа даже при концентрации 5 ppm. Поэтому одно только ощущение запаха паров опасного газа не может служить надежным подтверждением присутствия этих паров в опасной концентрации. Справедливо и обратное утверждение: при отсутствии запаха не следует делать вывод об отсутствии этих паров в опасной концентрации.
