На бескрайних просторах мирового океана, где могучие суда и корабли бороздят водные глади, существует невидимый враг, способный нанести колоссальный ущерб – биообрастание судов. Это сложный процесс, при котором разнообразные виды морских организмов и животных, которые прикрепляются к подводной части корпуса, образуя колонии. Если не принимать своевременные методы защиты, то последствия биообрастания для судов и кораблей могут быть катастрофическими: от замедления хода и увеличения расхода топлива до ускоренной коррозии металла и разрушения деревянных конструкций.
В этой статье мы подробно рассмотрим основных морских вредителей, участвующих в этом процессе, изучим механизмы их прикрепления к поверхности и разберем современные подходы к защите корпуса судна, включая применение эффективных антиобрастающих покрытий. Мы углубимся в мир морских древоточцев, бактериальных биопленок, различных видов водорослей, а также узнаем о роли спор и личинок беспозвоночных организмов, таких как морские уточки, балянусы, асцидии и мшанки, в процессе обрастания кораблейп. Понимание этих процессов является ключом к сохранению флота и обеспечению его долговечности.
Морские древоточцы
Древоточцы относятся к морским организмам, наносящим ущерб деревянным конструкциям судна: они не участвуют в процессе обрастания, но вызывают разрушение древесины, истачивая ее. Люди обратили внимание на существование морских древоточцев в то время, когда только впервые взяли плавающее бревно для переправы. Когда же началось развитие прибрежной навигации, стали выбирать наиболее прочные и доступные виды древесины.
Изучению древоточцев было посвящено большое количество работ. В начале XVIII в. в Голландии была опубликована работа, показавшая, что наибольший ущерб кораблям наносят моллюски-древоточцы. Для защиты от них рекомендовалась обработка древесины креозотом. Из других способов борьбы с морскими древоточцами были известны обугливание, окраска, обшивка металлическими листами.

Термин «морской древоточец» объединяет большое число видов (моллюски, ракообразные, грибы, водоросли, эхинодермы и др.), но основная масса их делится на две группы – моллюски и ракообразные. Большинство древоточцев проникают в твердый субстрат только для своей защиты, но растительные древоточцы, принадлежащие к Teredinidae и Xylophagainae (моллюски), Limnoriidae и Sphaeromiidae (ракообразные), используют древесину, в которую проникают, в качестве продукта питания. Эти древоточцы, а также Martesia и Lignopholas (моллюски, которые не питаются древесиной) – самые важные организмы, разрушающие деревянные конструкции в море.
Древоточцы разрушают древесину очень быстро. При благоприятных для них условиях сваи разрушаются за один-два года, а обшивка деревянных судов – за несколько месяцев. При этом снаружи их трудно увидеть, часто они обнаруживаются уже тогда, когда внутри древесина оказывается полностью разрушенной.
Органом для бурения древесины у Teredo navalis, как и у других моллюсков-древоточцев, является раковина, которая перемещена к передней части тела. В процессе развития она уменьшилась в размере и приобрела острую зубчатость вдоль края раковины, которая служит орудием в процессе бурения. Некоторые виды моллюсков-древоточцев хорошо приспособились к условиям защиты морских конструкций. Так, моллюски Martesia портят деревянные сооружения, защищенные составами, содержащими креозот, a Martesia striata могут сверлить даже свинцовую оболочку силового кабеля. На рис. 1 показаны стадии развития древоточцев Teredo navalis.
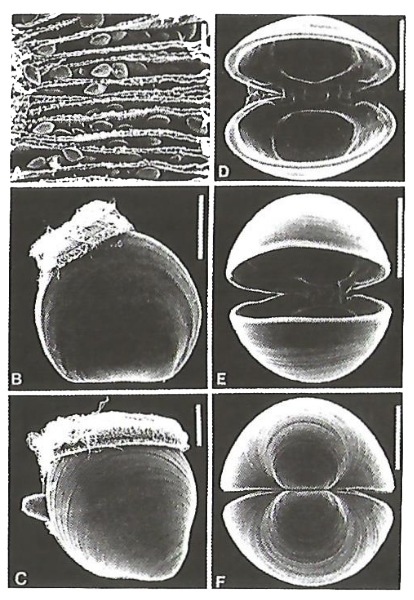
А-С – образцы в покое; D-F – образцы с удаленными мягкими частями и чистыми створками
Основу для питания моллюсков-древоточцев составляет азот. Главным продуктом питания многих моллюсков является древесина, но в некоторых случаях ее недостаточно. Потребность древоточцев в азоте может быть удовлетворена комбинацией фитопланктона, содержащего азот, утилизацией и переработкой азота и захватом растворенных органических азотсодержащих соединений. Было показано, что Bankia gouldi может утилизировать аминокислоты. Возможно, моллюски-древоточцы способны перерабатывать азотсодержащие отходы.
К древоточцам относятся также ракообразные – это очень активные изоподы, которые приносят в некотором отношении большую пользу, перерабатывая с большой скоростью упавшие и плавающие деревянные объекты. Однако их деятельность чрезвычайно вредна, когда она направлена на оборудование и конструкции из древесины. Одним из характерных представителей ракообразных древоточцев является Limnoria lignorum (рис. 2). Он питается, как и другие ракообразные древоточцы, микроскопическими грибами и гетеротрофическими бактериями, живущими в туннелях. Эти микроорганизмы живут также на оболочке древоточцев, которые содействуют распространению их спор, двигаясь внутри древесины. Limnoria lignorum обладает большим количеством ассоциированных бактерий (107 на одну особь), обычно среди них доминирует четыре вида: Aeromonas, Pseudomonas, Vibrio, Acinetobacter. Они колонизируются почти на всей доступной поверхности экзоскелета, т. е. твердой оболочки тела. На рис. 2 показан этот процесс. Следует отметить, что скорость бурения древесины у ракообразных древоточцев не столь высока.
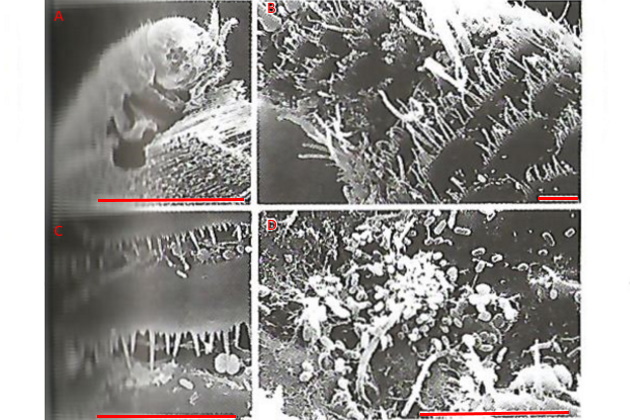
А – Limnoria lignorum, выбирающаяся из норки; В – колонизация бактерий на поверхности антенн экзоскелета; С – поверхность спинной части экзоскелета, имеющая сложную поверхностную структуру, и осевшие на ней микроорганизмы; D – типичная бактериальная флора на поверхности плеопода – брюшных ножек
Какие есть способы борьбы с морскими древоточцами на судах? Для защиты от древоточцев применяют пропитку древесины составами, убивающими личинки древоточцев: применяют креозот, растворы медного купороса, каменноугольные масла, а также лакокрасочные покрытия, соблюдая при этом важное условие – покрытие должно быть сплошным, без проколов и дефектов, в которые могут проникнуть личинки древоточцев.
Бактериальные биопленки
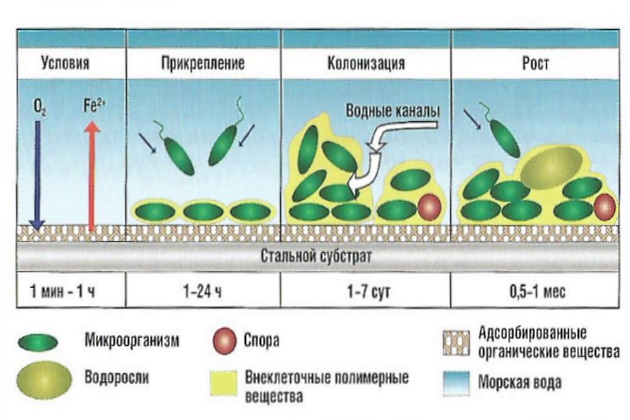
Образование бактериальных биопленок обычно является началом образования и развития сообщества организмов, составляющих морские отложения. Ему предшествует сорбция свежей пленки полимеров из морской воды. Металлические поверхности, помещенные в морскую воду, сразу же покрываются монослоем полимерного материала. Эти полимерные пленки определяют успех и прочность образования первичной микробиопленки. Подходящая пленка обычно состоит из высокомолекулярных гликопротеинов. Существует прямая корреляция между поверхностным натяжением на твердом субстрате и способностью к образованию микробиопленки: образование полимерной пленки на поверхностях, находящихся в морской воде, как правило, понижает критическое поверхностное натяжение, способствуя отложению первичной бактериальной пленки. Плотные и плоские слои на субстрате с высокой поверхностной энергией и высокой полярностью хорошо подходят для образования микробиопленок.
Рекомендуется к прочтению: Ремонт подводной части судов
Все подвижные морские бактерии имеют хеморецепторы, которые могут обнаруживать очень низкие концентрации химических веществ – до 10-6 молей. Бактерии, обычно находящиеся в состоянии броуновского движения, притягиваются к различным органическим соединениям, аккумулированным морскими поверхностями, включая полипептиды, аминокислоты и сахара. Многие клетки имеют флагеллы (жгутики), что позволяет им активизировать движение в небольших пределах, особенно в области с возможным присутствием химических веществ.
Бактерии держатся на некотором расстоянии от поверхности за счет энергии электрического отталкивания двойного слоя. Критическим является расстояние от поверхности менее 20 нм, когда между бактерией и субстратом начинает действовать энергия взаимодействия Гиббса. Взаимодействие происходит примерно на расстоянии 10 нм от поверхности, и бактерия сначала не имеет прямого контакта с поверхностью. В этой обратимой фазе образования биопленки бактерии слабо удерживаются на твердой поверхности и легко удаляются.
Сорбция становится необратимой после образования бактериями внеклеточного полимера. Перед этим бактерия должна преодолеть барьер электрического отталкивания между субстратом и бактериальной клеткой, что происходит на расстоянии менее 1-2 нм от поверхности за счет действия водородных связей, сил ионного, дипольного и гидрофобного взаимодействия. Возникновение адгезии обусловлено образованием внеклеточных полимеров, которые служат своего рода «клеем» для закрепления бактерий на поверхности; природа и происхождение этих соединений еще не полностью установлена. Микробиополимеры, по всей видимости, представляют собой комплексы полисахаридов с белками, мукополисахариды или гликопротеины. Эти бактериальные полимеры действуют как адгезивы и гарантируют постоянство закрепления биопленки на субстрате, изолируя его поверхность от водного слоя. Первичная пленка растет, используя питательные вещества с поверхности, и в то же время бактерии производят большое количество полимеров, способных задерживать «обломки» и другие микроорганизмы.
В результате этого возникает вторая микробиологическая популяция. Скорость ее развития зависит от содержания питательных веществ в окружающей среде: в воде открытого океана вторичная популяция может расти неделями, а в прибрежных водах она развивается за несколько дней. Полное развитие поверхностной популяции характеризуется присутствием большого количества стебельчатых и волокнистых бактерий. Кремниевые и зеленые водоросли запутываются в полимерной пленке, грибы и актиномицеты попадают в нее редко. На рис. 3 показана кульминация развития биопленки: на нем видны отчетливо бактериальные полимеры и «обломки».

На рис. 4 можно отчетливо видеть образование цепочечной бактерии, на рис. 5 видны волокна бактерий, а на рис. 6 можно увидеть полимерные «якоря», связывающие палочкообразные бактерии с поверхностью.


В начале колонизации бактерий преимущество для необратимой сорбции имеют маленькие стержнеобразные бактерии. Они способны к репродукции при низком содержании в воде питательных веществ и производят внеклеточный полимерный волокнистый материал. Бактерия, прикрепленная полисахаридными волокнами, может выдержать огромные разрушающие нагрузки. Способность организмов к колонизации обеспечивается наличием у них ворсинок, различных захватывающих приспособлений, а также полимерных выделений – секреций.
Процесс колонизации бактерий сложен и часто зависит от окружающей среды и концентрации в ней питательных веществ. Первоначально на субстрате осаждаются небольшие бактерии закругленной формы, через несколько дней на поверхности доминируют волокнообразные или палочкообразные бактерии. Предполагается, что вторичные организмы осаждаются при стимуляции условий для их колонизации, выполняемой первичными организмами. Внеклеточные полимеры, ответственные за закрепление бактерий, как полагают, обладают избирательностью. Показано, что первичные бактерии производят разнообразные гидролитические энзимы, которые могут катализировать гидролиз материала бактериальных клеток и других адсорбированных органических остатков, создавая при этом доступные растворимые питательные вещества.
Читайте также: Окраска корпуса судна
Следует учесть, что каждый определенный тип бактерий при всех равных условиях имеет свою скорость роста. Физические и химические свойства субстрата являются важным фактором, определяющим, какие организмы будут включены в биопленку и насколько прочным будет их закрепление. На колонизацию бактерий влияют и свойства окружающей среды, например pH, температура, окислительно-восстановительный потенциал и др. Все это обусловливает огромное разнообразие микробиопленок.
Бактериальные пленки очень важны на ранних стадиях развития колоний беспозвоночных. Осаждение на поверхностях и метаморфоз личинок многих морских беспозвоночных зависят от присутствия бактериальной биопленки. Метаболические продукты бактерий способствуют возникновению хемотактических сигналов для привлечения спор водорослей и личинок. Бактериальные гликопротеины включаются в осаждение некоторых водорослей и личинок путем связи с лектинами эукариотов.
Морские водоросли
Морские водорослиОсобенности обрастания водорослями и моллюсками корпусов судов являются таллофитами – растениями без корней, стеблей и листьев – в основном водными, способными к фотосинтезу и кислородной автотрофии (способу питания за счет окисления неорганических соединений). Это определение относится к цианобактериям (Chloroxybacteria), которые являются фотосинтетическими прокариотами, близкими к бактериям. Микроводоросли включают все виды, которые можно наблюдать только под микроскопом: от 2 мкм для Nannochloropsis (ортофиты) до 100 мкм для Ceratium (дипофлагеллаты). Соответственно макроводоросли включают все виды, которые можно видеть невооруженным глазом. Их размеры колеблются от нескольких сантиметров (как у Polzsiphonia lanosa – родофиты) до нескольких метров, в частности Macroczstis pyrifera – охрофиты могут иметь длину до 50 м.

Классификация водорослей принципиально основана на трех главных характеристиках: состав пигмента, природа накопления продукта и состав клеточных стенок. Морские водоросли включают семь главных типов, которые приведены в табл. 1. Количество видов водорослей окончательно не установлено, оно насчитывает 36 000-50 000, возможно и больше.
Как морские водоросли влияют на экосистему и суда? Они являются основной пищевой базой и ключевым компонентом морской экосистемы. Их продуктивность напрямую воздействует на количество пищи, доступной для травоядных организмов, и косвенно — для всех остальных морских обитателей. Большая часть микроводорослей составляет планктон в противоположность макроводорослям, которые в основном относятся к бентосу – флоре морского дна. Только несколько видов, например Sargassum muticum и Sargassum fluitans, способны жить, перемещаясь в воде. Соперничество в обнаружении подходящего субстрата очень важно для сообществ макроводорослей и может частично объяснить большое разнообразие макроводорослей, включенных в биоосаждение, по сравнению с микроводорослями. В этом соревновании преимущество имеют водоросли с большой скоростью роста. Для разных видов ее значение очень различается: от 1 г-1/ч-1 (в пересчете на сухую массу) для Sargassum policeratium до 11 для Chaetomorpha linum.
Основными факторами, влияющими на распределение морских водорослей, являются глубина (связанная с интенсивностью света) и доступность питательных веществ.
Морские водоросли, обладающие фотосинтетическим метаболизмом, имеют высокую потребность в свете и, как следствие, могут находиться только в зоне глубиной примерно 200 м в зависимости от прозрачности воды, т. е. до предельной глубины, куда свет не может проникать. Чувствительность водорослей к свету определяется входящим в их состав пигментом. Эта характеристика вместе с высыханием и изменением солености ответственна за зону размещения водорослей в прибрежной полосе, которое в зависимости от глубины отражается на окраске.
Наличие питательной среды также является одним из главных факторов роста морских водорослей. Азот (составная часть аминокислот, нуклеотидов и хлорофилла), углерод (основная составляющая клеток) и фосфаты (составная часть АТР, АДР и фосфолипидов) являются для водорослей основными питательными элементами. Кроме того, для их роста необходимы некоторые другие элементы, например кремний или кальций для определенных видов водорослей.
Вторичными элементами являются железо (включенное в состав антимикробных и альгицидных соединений), кобальт (в составе витамина В12), магний (компонент хлорофилла) и марганец. Изменения концентраций этих элементов сильно влияют на рост водорослей и разнообразие их сообществ. В океанских водах наиболее важным компонентом питательных веществ является азот. Однако в результате производственной и хозяйственной активности человека содержание нитратов и фосфатов в прибрежных водах уменьшилось. Влияние температуры воды на рост водорослей на судах, а также доступность питательных веществ определяют циклы их расцвета в различных широтах.
В тропической зоне продуктивность морских водорослей обычно гомогенна в течение всего года благодаря малым колебаниям температуры и интенсивности света. В умеренном климате в океанических водах обычно наблюдаются два пика расцвета водорослей – в марте-апреле и в сентябре-октябре. Во время первого пика преобладают кремниевые водоросли, возможно, благодаря высокой доступности кремния, хорошим внешним условиям и их способности преобладать над другими видами. Во второй пик образуются водоросли других групп благодаря недостатку кремния из-за перерасхода его во время первого пика и подходящим внешним условиям (температура, питательные вещества). В арктической зоне наблюдается только один пик продуктивности водорослей из-за короткого периода благоприятных условий для их развития.
Предлагается к прочтению: Особые случаи докования судов
Формами расселения бактерий, одноклеточных водорослей и простейших являются клетки, которые могут переноситься течениями на большие расстояния. Для макроводорослей формами расселения служат споры, а у беспозвоночных животных – личинки. Жизненный цикл обрастателей можно представить состоящим из двух периодов – планктонного и перифитонного (обрастание). Основные виды морских водорослей, колонизирующихся на искусственных поверхностях, приведены в табл. 2.
Несмотря на большое разнообразие морских водорослей, только несколько видов используются для оценки силы действия осажденных продуктов на механизм адгезии в лабораторных условиях. Из микроводорослей обычно изучают вид Amphora, который доминирует в осажденных колониях, из макроводорослей для исследований применяют виды Ulva, Cladophora, Sargassum muticum.
Микроводоросли – микрообрастатели
Микроводоросли являются одной из составных частей морской биопленки. Далее следует колонизация макроорганизмов, таких, как макроводоросли и беспозвоночные животные организмы. В морских экосистемах кремниевые водоросли (или диатомовые) составляют большую часть биомассы на новых субстратах на ранних стадиях колонизации. Название этих водорослей связано с тем, что их панцирь состоит из аморфного кремнезема. Кремниевые водоросли являются первыми автотрофными колонизаторами и, таким образом, ответственны за большую часть энергии, поставляемой к поверхности в форме редуцированного (восстановленного) углерода.
Кремниевые водоросли представляют собой ограниченную группу организмов. Основные виды, относящиеся к этой генерации, следующие:
- Amphora,
- Cocconeis,
- Licmophora,
- Navicula,
- Nitschia,
- Pleurosigma,
- Synedra,
- Tropidoneis.
Кремниевые водоросли бывают бесшовные, одно- и двухшовные.
Для водных микроорганизмов адгезия к субстрату необходима, чтобы растворимые питательные вещества и свет были более доступными. При погружении поверхности в воду образование биопленки проходит за несколько секунд или минут. Бактерии, как показано выше, образуют микробиологическое обрастание (пленку), которая необходима для последующих двух стадий. Следующая стадия начинается с осаждения простейших одноклеточных организмов и кремниевых водорослей.
Адгезия микроводорослей в большинстве случаев состоит из трех стадий:
- местонахождение на поверхности;
- первоначальный контакт;
- вторичная адгезия для окончательного осаждения.
Первая стадия процесса колонизации состоит из обнаружения подходящего места на субстрате. Диморфный цикл жизни некоторых микроводорослей со стадией свободного плавания, предшествующей закреплению, усиливает распространение и колонизацию на новых поверхностях. Подвижные водоросли (например, с флагеллой) могут применить свою способность находить новую поверхность, но она ограничена очень малыми расстояниями. Raphid-кремниевые водоросли находят место для колонизации только случайно.
Первоначальный контакт может включать мимолетное химическое притяжение между клетками и поверхностью. В этой фазе raphid-кремниевые водоросли активируют адгезионный механизм, используя энергию для последующей связи с субстратом. Фаза первого контакта обратима, клетки могут освобождаться в не очень подходящих для них условиях и при необходимости способны регулировать свое положение благодаря присущей им подвижности, называемой «планированием», которая включает выделение клейкого вещества.
Процесс первоначального адгезионного контакта, описанный для raphid-кремниевых водорослей Stauroncis decipiens, иллюстрирует соотношение между адгезией и подвижностью, что, по-видимому, является необходимой составляющей адгезионного комплекса (АК). Этот комплекс состоит их ассоциированных молекул, протянутых из цитоскелета через трансмембранные связи к внеклеточной матрице и поверхностному адгезиву, что в результате обеспечивает адгезию кремниевой водоросли на субстрате (рис. 7).
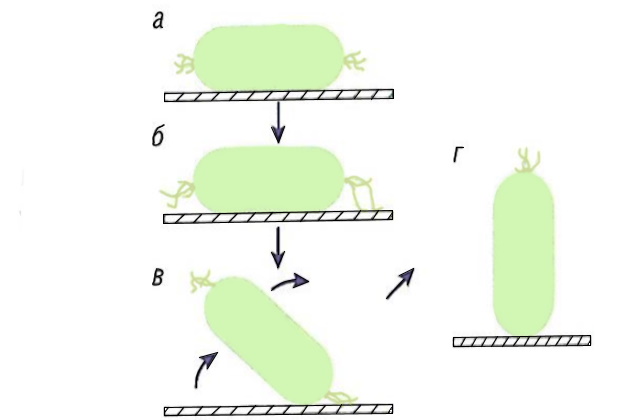
а – посадка; б – контакт и соотношение между подвижностью и адгезией; в, г – подъем клетки
Stauroneis decipiens сначала контактирует с плоской поверхностью субстрата своей поясной частью, но не швом, поэтому необходима серия маневров, чтобы расположиться на шве и активировать АК.
Кремниевые водоросли могут легко быть смещены во время первого процесса соприкосновения и прикрепляются прочно в течение 30-90 с.
В случае raphid-кремниевых водорослей шов участвует в адгезии, а для бесшовных водорослей адгезия, вероятно, имеет место в нескольких точках фрустулы с внеклеточной секрецией клеящего вещества, включая молекулы адгезива. В результате адгезии этих водорослей образуются разные структуры – стебли и щитки.
После первоначального контакта клетки могут активировать вторую стадию, называемую вторичной адгезией, которая включает постоянные адгезивные структуры. Благодаря более сильной адгезии клеток к поверхности водоросли затрачивают меньше энергии, чем в предыдущей фазе, но все же могут освободиться при ухудшении внешних условий.
Для некоторых морских организмов, к которым относятся кремниевые водоросли и цианобактерии, гидрофобные свойства клеточной стенки являются важным фактором в адгезионном процессе. В этом случае требуется присутствие двухвалентных катионов (кальция и магния) для уменьшения электростатического отталкивания между отрицательно заряженной клеточной стенкой и субстратом.
На рис. 8 приведены микрофотографии кремниевой водоросли в процессе ее прикрепления к субстрату.

а – негатив материала субстрата после удаления клеток кремниевой водоросли с помощью химического препарата, масштаб 5 мкм; б – Amphora cojfeaeformis на полистирольном субстрате, масштаб 1 мкм; в – поперечный разрез, виден материал для прикрепления, выделяющийся из канала шва, масштаб 0,5 мкм; г – сканирующая электронная микрофотография. Клетка «села» на поверхность полистирольного субстрата за 5 мин до фиксации. Из канала шва появляются структуры для прикрепления (адгезив)
Приведенные на рис. 8 микрофотографии позволяют представить процесс выделения адгезива из каналов шва для закрепления на поверхности. Опубликована серия подобных микрофотографий; авторы этой работы предполагают, что внеклеточное клейкое вещество синтезируется и затем транспортируется к каналу шва в пузырьках, которые постоянно разрываются, высвобождая это вещество.
В этом процессе интересна роль кальция, который может включаться в биосинтез адгезивного вещества как ион-регулятор. Он может также вызывать структурные изменения самого адгезива и таким образом регулировать адгезивные свойства молекулы. Кальций связан с подвижностью кремниевой водоросли. Предполагают также, что микроволокна в области шва цитоплазмы могут быть вовлечены в качестве сокращающихся протеинов в клеточное передвижение. Также возможно, что эти микроволокна действуют в простой зависящей от кальция сокращающейся системе, которая выкачивает адгезив из шва.
Будет интересно: Механическая мастерская на судне
Какие могут быть причины образования биопленки на корпусе судна?
Считается, что кальций играет центральную роль в регулировании биологических процессов. Адгезия является как раз одним из многих явлений, в которые вовлечен кальций. На рис. 9 приведена зависимость адгезии водоросли Amphora coffeaeformis от содержания кальция в морской воде. Видно, что при увеличении концентрации кальция до 2,5 ммоля адгезия увеличивается примерно в 7 раз, дальнейшее повышение его концентрации уже не влияет на адгезию.
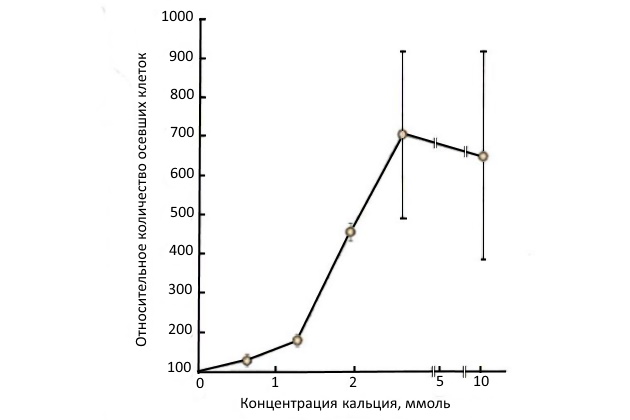
Следует отметить тот факт, что микрообрастание металлической поверхности увеличивает ее коррозионное разрушение, в этом процессе – биологической коррозии – участвует и бактериальный слой.
Влияние микроорганизмов на коррозию металла состоит прежде всего в образовании продуктов анодных и катодных реакций, которые создают пленки. Кроме того, сами микроорганизмы, связанные с металлической поверхностью, влияют на процесс коррозии. Суммарный результат механизмов, способствующих коррозии, свидетельствует о роли микроорганизмов в увеличении коррозии.
Макроводоросли и макроорганизмы – макрообрастатели
После того как на природном или искусственном субстрате произошла колонизация микроорганизмов, таких, как бактерии и микроводоросли, с этими поверхностями способны связаться макроорганизмы (макроводоросли и животные организмы). Это явление происходит обычно в течение недели после образования органической пленки. После колонизации микроскопических диатомовых (кремниевых) водорослей появляются такие типы обрастаний: сине-зеленые водоросли (Cyanophita), содействующие появлению большого количества макроводорослей групп Clorophita (зеленые водоросли), Phaeophita (бурые водоросли) и Rhodophita (красные водоросли). Колонизация на новом субстрате макроводорослей является ответственной стадией в их жизни и включает несколько фаз, которые будут рассмотрены ниже.
Как отмечалось, формами расселения макрообрастателей являются споры и личинки. Они находятся в планктоне только до момента оседания. Споры красных и некоторых видов зеленых водорослей не имеют жгутиков для движения в воде, они высыпаются из спорангиев под давлением, развивающимся в них. Такие споры переносятся течениями. Выход в планктон личинок беспозвоночных и асцидий происходит активно путем плавания. Для личинок характерно пелагическое развитие (в морской воде), оно обеспечивает построение колоний на любых твердых поверхностях. Пелагическое развитие является основным для населяющих колонию видов и характерно для 70 % бентосных беспозвоночных. Поскольку личинки сильно отличаются от взрослых особей, то для них создана отдельная номенклатура, приведенная в табл. 3.
- * – важные группы обрастателей;
- + – группы, важные среди морских культур;
- ** – пелагическая форма личинок многих моллюсков, часть свободно плавающего планктона. Педиведигер – стадии, когда личинка развивает ногу и готова присоединиться к твердой поверхности постоянно.
Личинки с пелагическим типом развития могут быть питающимися (планктотрофными) и непитающимися (лецитотрофными), первые более распространены. Лецитотрофные личинки губок, кишечнополостных, полихет семейства Spirordidae, большинства мшанок и асцидий существуют короткое время – несколько часов или дней. Большинство полихет и моллюсков, ракообразные, иглокожие и некоторые другие имеют планктотрофные личинки, которые живут недели и месяцы. Важным условием жизни личинок в составе планктона является поддержание плавучести, чтобы расселиться на возможно большей территории.
Личинки беспозвоночных и подвижные споры макроводорослей имеют специальные приспособления для сохранения вертикального положения – это всевозможные выросты, способствующие планированию и плаванию; их плавучесть увеличивает также запас жира – липидов, его особенно много у лецитотрофных личинок. Кроме того, у многих личинок развиваются поверхностные структуры, например пучки щетинок на конце, конечности циприсов усоногих раков и др. (рис. 10).
а – вид спереди; б – вид сбоку
Например, личинки усоногих раков – науплиусы и циприсы – двигаются исключительно путем резких и частых ударов конечностей, т. е. мышечным способом.
То же свойственно личинкам двухстворчатых раков и асцидий. Локомоция или двигательная активность является важным свойством личинок.
После определенного периода развития в планктоне личинки становятся готовыми к оседанию и дальнейшему развитию на твердой поверхности, т. е. к перифитонному состоянию. Оно имеет несколько стадий: исследование субстрата, временная адгезия и окончательное прикрепление. На первой стадии основными факторами являются свет и гравитация, они определяют общее направление движения и место оседания (рис. 11).
Макроводоросли поселяются в самых освещенных местах судна, поэтому они распространены от ватерлинии вниз вдоль бортов и не встречаются на днище. Ближе к поверхности воды поселяются зеленые водоросли, ниже – бурые, еще ниже – красные. Такое распространение связано с различным их отношением к интенсивности и спектральному составу света.
Еще ниже располагаются животные обрастатели – гидроиды, многощетинковые (седентарные) черви, усоногие раки, моллюски, мшанки.
В выборе субстрата участвуют сенсорные системы. Чувствительными органами являются скопления сенсорных клеток, в основном на щупальцах. Все сенсорные системы представляют собой чувствительные щетинки, связанные с отростками дендритов нейронов. Двигаясь по поверхности, личинки плотно прижимают свои антеннулы, что позволяет им оценивать пригодность субстрата для оседания на нем.
Чувствительными органами у циприсов являются антеннулы, два сложных глаза, науплиальный глаз, щетинки каудальных придатков и некоторые другие. У педивелигеров двухстворчатых и брюхоногих моллюсков это теменная пластинка, глаза, чувствительные ресничные клетки брюшной поверхности. У некоторых мшанок (личинка цифонаут) чувствительный орган – грушевидный, он выполняет хемосенсорную роль и связан с пучком нервных и мышечных волокон. У личинок морских ежей – зачатки ножек, на поверхности которых сенсорные ресничные клетки. Личинки асцидий имеют хорошо развитую нервную систему.
Их локомоторный орган – хвост с мышечным аппаратом. Основные органы чувств – это стратоцист – орган равновесия и личиночный глаз, находящийся в пузырьке. Основную роль в выборе субстрата выполняют рецепторы в сосочках прикрепительного аппарата, одновременно обладающего чувствительной и прикрепительной функциями. Во время поисков подходящего места на субстрате личинке удается удержаться на нем при турбуленции воды. Но если личинка находит выбранное место неподходящим, то она способна его покинуть, перейти в воду и искать другое место.
Читайте также: Ремонт корпусных конструкций и судовых устройств
При колонизации на новом субстрате макроводоросли используют несколько стратегий. Чаще всего – распространение материала, необходимого для репродукции, например спор, гамет, зигот, части талли или боковых отростков ризоидов (внешне это подобная корням часть водоросли). Колонизация состоит из нескольких стадий, включая пелагическую (диспергирование в столбце воды) и фазу образования бентоса (локализация на субстрате и закрепление на нем).
Последний процесс – фиксации и развития организмов – в свою очередь состоит из трех главных стадий (рис. 12):
- локализация и закрепление на поверхности, этот процесс зависит от физических и химических свойств поверхности субстрата, а также биологических свойств спор;
- адгезия при первоначальном контакте и вторичном взаимодействии;
- образование клеточной стенки, приобретение полярности клеток и процесс прорастания.
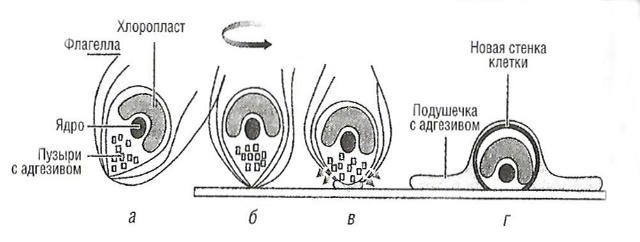
а – свободное плавание споры; б – локализация на поверхности, вращение на верхушке бугорка; в – высвобождение адгезива (≈ 1 мин); г – постоянная адгезия, втягивание флагеллы (≈ 2-3 мин), возникновение клеточной стенки ~ 20 мин
Морфология спор, условия окружающей среды и свойства субстрата являются наиболее важными факторами при локализации на субстрате. В зависимости от вида водоросли споры имеют одну или несколько флагелл. Неподвижные споры достигают места закрепления только за счет физических сил, из которых главной является сила тяжести, в то время как подвижные клетки могут активно распознать поверхность для колонизации. Вязкость водного столба не позволяет спорам использовать свои флагеллы во время распространения. Однако эта фаза очень важна для выбора субстрата и установления контакта с поверхностью для колонизации. Многие зооспоры плавают наугад, но многие из них развили фото, сигмо и хемотактические возможности. Опытным путем было показано, что некоторые споры водорослей способны чувствовать химические сигналы, продуцируемые микроорганизмами, присутствующими внутри биопленки.
Поверхностные характеристики субстрата, такие, как цвет, гладкость, твердость и поверхностная энергия, могут влиять на процесс колонизации. Некоторые водоросли выбирают очень твердые поверхности, другие предпочитают более мягкие; одни выбирают известняк, другие гранит и т. д. Энергия поверхности также влияет на некоторые водоросли, например Ulva, путем изменения морфогенетического развития ризоидов. Свободная энергия поверхности, продуцируемая атомами или молекулами на поверхности субстрата, является подходящей для создания взаимодействия между организмами, атомами или молекулами этой поверхности.
Это взаимодействие может быть различных типов, например силы Ван-дер-Ваальса, полярные, электростатические и гидрофобные. Чем меньше свободная поверхностная энергия, тем слабее адгезия организмов. Сила прикрепления спор Ulva больше на гидрофильных поверхностях. Однако большое количество этих же спор оседает на гидрофобных поверхностях, и на них образуются кластеры этих спор большего размера. На процесс колонизации могут влиять присутствующие на поверхности организмы, а бактерии могут модифицировать микротопографию и физико-химические свойства поверхности субстрата.
Фаза осаждения заканчивается установлением контакта. Он достигается, когда спора или личинка переходит от фазы свободного плавания к локализации на поверхности.
Адгезия к поверхности
Адгезивные свойства различных микроорганизмов к затененным и светлым поверхностям.
Споры
Адгезия к новой поверхности управляется большим числом факторов для подвижных и неподвижных спор. Большое значение имеют свойства субстрата и биологические сообщества, уже присутствующие на нем. Адгезия происходит в течение 30-60 с и состоит из двух главных фаз – первичного и постоянного закрепления.
Временное или первичное прикрепление. Зооспоры обладают единственным хлоропластом в передней части клетки, ядром в центре и многими пузырьками на крышке клетки. Когда происходит контакт, то верхушечная область клетки выравнивается и активность цитоплазмы увеличивается до тех пор, пока из пузырька не вытечет адгезив.
Постоянное или вторичное прикрепление происходит быстро, например в течение 1 мин для спор типа Viva. Во время этого процесса флагеллы удалены, споры сокращаются и распрямляются против поверхности, чтобы увеличить поверхность для адгезии, и выделяют из пузырьков адгезив – гликопротеины в виде геля. Образующаяся подушечка толщиной около 1 мкм служит якорем для споры, после ее прикрепления до затвердения проходит примерно 1 ч. Сила адгезии достаточно велика и составляет (173 ± 1,7) мН·м-1. Это важно знать для своевременного подавления фазы прикрепления, так как на удаление водорослей с поверхности необходимо затратить большую энергию.
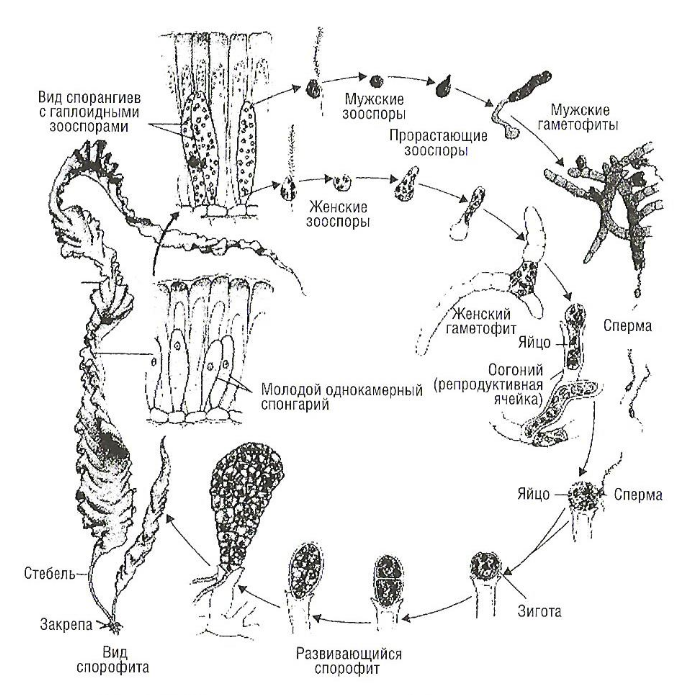
Установление. Эта фаза относится к созданию клеточной стенки и потери флагелл. Во время этого процесса клетка может прорастать, образуя гаметофит или спорофит. Цикл жизни водоросли сильно различается для разных видов водорослей и может быть сложным. Он часто состоит из двух генераций за исключением родофита, которые имеют три генерации: гаметофит, спорофит и карноспорофит. Гаметофит и спорофит могут иметь подобные форму и размер, например для Ulva, и могут быть различными, но легко отличимыми друг от друга, например для ламинарии. Гаметофиты являются гаплоидными и продуцируют мужские и женские гаметы. Когда оплодотворение произошло, и если зигота может устроиться и развиваться, вырастает спорофит. Эта генерация диплоидна и производит споры, которые развиваются в гаметофиты. На рис. 13 показан цикл жизни макроводоросли Laminaria sp.
Личинки беспозвоночных организмов
Для временного прикрепления личинок в подводном окружении существует два способа: приспособления для присасывания и секреция вязкого клейкого вещества. Относительно быстро передвигающиеся организмы, например октопусы, кальмары, морские звезды, успешно используют приспособления для присасывания. Моллюски, морские актинии и оболочники применяют секрецию клейкого вещества и для постоянного прикрепления, и для обеспечения медленной скорости изменении положения при временном прикреплении.
Этот тип адгезии более распространен для морских организмов. Ряд личинок применяет оба типа прикрепления одновременно, т. е. секреция клейкого вещества происходит в области присасывающего устройства. Для перемещения и прикрепления на одном месте используются разные типы клейкой секреции. Так, Patella vulgata имеет девять разных желез, шесть из них выделяют секрецию под подошву, протеин подается из краевой железы в краевой желобок и используется при передвижении, а высоковязкие кислые мукополисахариды выделяются для адгезии на постоянном месте.
Для постоянного прикрепления организмы с подвижностью своих взрослых форм, такие, как актинии и оболочники, обычно используют клейкую секрецию. Только морские организмы, прикрепляющиеся на всю жизнь, например балянусы и трубчатые черви, используют затвердевающий адгезивный цемент, иногда подкрепленный известняковыми осадками.
Личинка оболочника использует для прикрепления адгезивный бугорок, который является органом для адгезивной секреции. Временное прикрепление сопровождается выделением очень вязкой слизи, которая предположительно состоит из протеина, содержащего сульфогидрил и дисульфидные группы вместе с карбогидратом. Временное прикрепление не является обязательной стадией. Если место оказывается удобным для постоянного закрепления, то процесс адгезии завершается секрецией соответствующих веществ. Двустворчатые моллюски, такие, как гребешки и мидии, при временном прикреплении сохраняют некоторую подвижность. Они закрепляются на субстрате с помощью прочной белковой нити, образованной выделениями специальной биссусовой железы, расположенной в ноге моллюска, но при неблагоприятных условиях они рвут нить, связывающую их с поверхностью, и отправляются на поиски нового места прикрепления.
Следует подчеркнуть, что способы прикрепления личинок разных видов макроорганизмов сильно различаются. Ниже рассмотрены несколько основных групп наиболее распространенных морских беспозвоночных организмов, а также показаны их временные и постоянные способы прикрепления.
Морские уточки (Barnacles)
Дарвин написал серию монографий, посвященных окаменелым и существующим в настоящее время морским уточкам. Этот подкласс ракообразных привлекал внимание эволюционных биологов, экологов и физиологов. Он включает более 1 200 видов, они поселяются в разных местах, в том числе в гидротермальных отверстиях и даже на коже китов.

Морские уточки относятся к типу антроподов, подклассу ракообразных. Они лучше других колонизирующихся морских организмов приспособлены к осаждению на искусственных структурах, погруженных в морскую воду, и поэтому доминируют среди животных организмов при обрастании. Barnacles более других обрастательных форм ответственны за увеличение затрат на топливо при движении судна (на 40 %). Одновременно подводная часть судна затрудняется в очистке от обрастания и они увеличивают финансовые затраты при очистке трубопроводов, нефтяных колец и навигационных буйков.
Рекомендуется к прочтению: Доки, используемые для транспортировки на разные расстояния
Морские уточки также вовлечены в процесс коррозии. Микросреда под местом их прикрепления создает хорошие условия для быстрого роста сульфатвосстанавливающих бактерий, которые играют важную роль в процессе коррозии.
Морские уточки уникальны среди ракообразных из-за исключительно сидячего образа жизни. Они делятся на три вида, отличающихся строением. Ниже более детально рассмотрен часто встречающийся среди обрастателей Способы борьбы с обрастанием корпуса судна разными морскими микроорганизмамирод балянусов или морских желудей.
Балянусы
Балянусы – род усоногих раков из подотряда морских желудей. Балянусы способны прикрепляться к погруженным в морскую воду искусственным объектам, включая корабельные корпусы, где они занимают свое место среди других осаждающихся организмов. Их относительно большой размер затрудняет борьбу с ними. Более того, их кальцинированная оболочка повреждает лакокрасочное покрытие, разрезая его изнутри, чем может провоцироваться подводная коррозия слоя металла.

Их распространение, большая плодовитость и способность колонизироваться на очень твердых поверхностях обусловливают образование отложений на мелководье. В этом процессе принимает участие вид Balanus amphitrite.
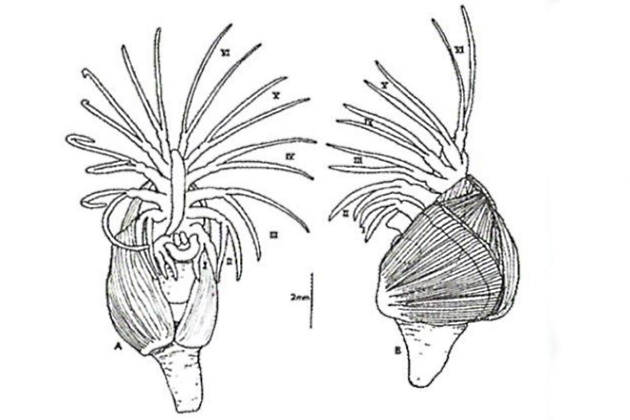
Способность к распространению характерна для стадии личинки, которая обладает очень стабильными формой и функциями; главная ее задача – найти соответствующее место для закрепления (рис. 14).
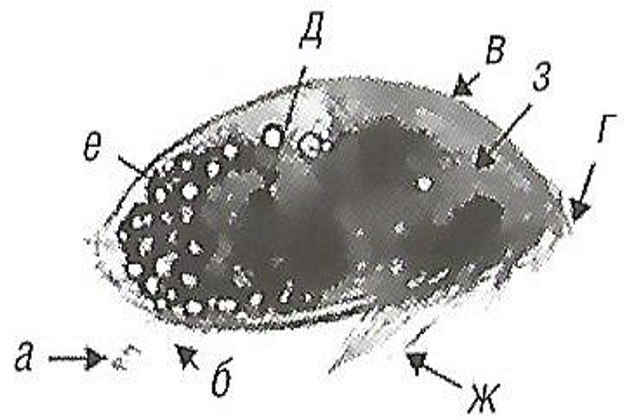
а – адгезивный диск; б – первый сегмент со щупальцами; в – щиток, г – хвостовидный придаток; д – сложный глаз; е – масляная ячейка; ж – грудной придаток; з – грудная клетка. Масштаб 100 мкм
Тело балянуса заключено в яйцевидный обтекаемый двухстворчатый каркас (щиток) и имеет шесть пар ножек и антеннулы. Ударами ног он может быстро продвигаться в воде, а посредством мускульных проворных щупалец закрепиться на твердом субстрате или ползти по поверхности.
На осаждение балянусов влияют свойства поверхности субстрата, а именно: смачиваемость, топография и цвет. Различные виды балянусов по-разному относятся к смачиваемости субстрата. Так, Balanus improvises осаждается быстрее на относительно гидрофобных поверхностях, a Balanus amphitrite – на гидрофильных поверхностях. В литературе часто оспаривают результаты подобных исследований, однако четко установлена важность контроля состояния поверхности субстрата. Влияние топографии поверхности для осаждения личинок хорошо известно: личинки беспозвоночных предрасположены к осаждению на грубых, а не гладких поверхностях. Однако точной оценки степени шероховатости поверхности в литературе не описано. Проведено очень большое число исследований поведения конкретных видов балянусов на определенных поверхностях. Все литературные материалы носят дискуссионный характер.
Особый интерес представляет влияние цвета поверхности на осаждение балянусов. Этот факт был давно известен. Ранее считалось, что осаждение чаще происходит на затененных областях корабельного днища. В ходе экспериментов был установлен оптимум световой интенсивности для определенных видов балянусов. Так, Balanus amphitrite максимально чувствительны к свету с длиной волны 530-545 нм.
Спектральная чувствительность Semibalanus balanoides шире и доходит до 600 нм. Эти заключения основаны на наблюдениях за поведением балянусов и силе их адгезии на панелях, окрашенных разным цветом с противоположных сторон. Балянусы приближались к темноокрашенным поверхностям – черным и красным и избегали светлых – голубых, желтых и белых. Таким образом, было показано, что цвет также влияет на силу адгезии этих беспозвоночных.
Механизм адгезии балянуса состоит в следующем: когда на его пути встречается подходящая поверхность, балянус начинает быстро поворачиваться, меняя направление, и с помощью дисков, снабженных парными антеннулами, прикрепляется к поверхности субстрата. Исследования показали, что способность рачка находить нужную поверхность для закрепления уменьшается с его возрастом.
Предлагается к прочтению: Эксплуатация плавучей буровой установки
С помощью электронной микроскопии было показано, что антеннулы состоят из четырех сегментов. Первый сегмент расположен около большого сложного глаза, второй – имеет мускулы и может вытягиваться далеко из каркаса. Третий сегмент расположен на конце длинной оси антеннулы и обычно называется α-диском за его плоскую закругленную поверхность. Четвертый сегмент гораздо меньше по размеру и выступает из края третьего сегмента справа к длинной оси антеннулы, его функция является предметом дискуссии. Антеннулы балянуса сложены так, чтобы получить нужное положение во время прикрепления, но процесс их распрямления происходит только один раз, не повторяясь. Складывание антеннул как бы завершает процесс временного присоединения, когда еще не происходит секреции цемента.
Поверхность каждого диска покрыта жесткими кутикулярными ворсинками. Роль их не совсем понятна: они могут служить для увеличения поверхности диска адгезии, чтобы компенсировать большие гидродинамические силы. Прикрепление происходит за счет секреции протеина, который выделяют специальные органы во втором, снабженном антеннулами диске, секреция протеина выходит на поверхность диска через два концентрических круга пор.
Одной из функций таких ворсинок может быть способность диска сохранять эту секрецию. Когда балянусы исследуют поверхность, чтобы прикрепиться к ней, протеин играет роль временного адгезива. Диск должен быть способен противостоять большой энергии отделения, когда присоединение происходит в больших количествах, чем требовалось бы при свободном отделении диска от поверхности. После того как балянус нашел подходящее место для осаждения, ему требуется вещество для постоянного закрепления на субстрате.
Это вещество, называемое «цементом», продуцируется парными железами, расположенными за сложными глазами, по достаточно сложному механизму. Упомянутые железы выделяются ячейками α и β-типов, α-ячейки содержат многочисленные круглые гранулы диаметром 3-4 мкм, которые осуществляют определенные реакции окрашивания для протеинов, фенолов и энзима полифенолоксидазы. β-ячейки, расположенные на спинном и брюшном краю желез, неправильной формы и большего размера. Их содержимое имеет меньшую электронную плотность, чем у α-ячеек, и окрашивает протеин.
Размеры набухания находятся в обратной зависимости с концентрацией хлорида натрия. Это говорит о том, что содержимое гранул подобно гидрофильному полимерному гелю. Матрица гранулы также липкая, но не твердеет в течение более 24 ч в противоположность выделяющемуся «цементу». Поэтому можно предположить, что содержимое β-ячеек важно для осуществления процесса полимеризации, имеющего место в двухкомпонентной системе.
Содержимое гранул поступает в срединную собирательную трубку цементной железы посредством экзоцитоза. Выделившийся на поверхность «цемент» образует куполообразную массу, которая внедряется в третий и четвертый сегменты с антеннулами, диаметр массы около 100 мкм для Balanus amphitrite и 150 мкм для Balanus Balanidae. Так как предположительно «цемент» не полимеризуется в трубке, то, вероятно, для образования поперечных связей требуется морская вода.
Прикрепившийся балянус освобождается от своего каркаса и экзоскелета, за исключением врезанных частей антеннул. Эта метаморфозa является переходом во взрослую форму. У Balanus Вalanidae главный канал цементирующей сетки проходов у взрослой особи начинает расти перпендикулярно к рострально-кардинальной оси, начинаясь с остатков второго антеннулярного сегмента до периметра основы. В каждый период роста в главном канале образуются новые пузырьки; они становятся точками, дающими начало для отделения сетки проходов. При этом каждый новый пузырек больше предыдущего и каждая сетка сложнее предыдущей. Конец каждого прохода расширяется и образует воронку для распределения «цемента» в концентрических кругах вдоль периметра растущей основы.
Главный канал разветвляется на множество боковых каналов, идущих в разных направлениях. Боковые каналы соединяются с большими круглыми органами (часто более 100 мкм в диаметре), которые являются огромными одноклеточными «цементными» железами и располагаются в ткани мантии близ эпителия, который выстилает полость мантии.
В очень тесных сообществах балянусов, что достаточно распространено, некоторые индивидуумы вынуждены размещаться, не имея возможности соприкасаться непосредственно с субстратом. В этом случае они выделяют большое количество «цемента», который заполняет пространство между основанием балянуса и субстратом, что показано на рис. 15.
Процесс подачи жидкой цементной субстанции является довольно сложным. Пузырьки в сочетании с главным каналом представляют собой уникальную систему, способную останавливать истечение, производить смешение с новым цементным материалом, а также направлять цемент в нужное место. Главный канал, проходящий через пузырьки, представляет собой непрерывную трубку (рис. 16). Часть канала, проходящая через пузырьки, является полупроницаемой и принимает участие в сложных процессах распределения «цементного» материала.
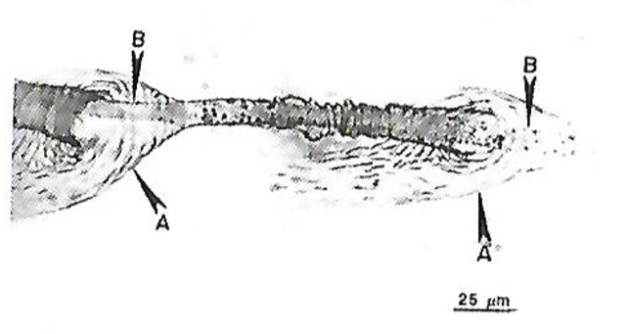
Химическая природа механизма затвердевания «цемента» балянусов была предметом многих исследований. Показано, что в его основе лежит сшивание хиноном. Этот механизм очень распространен для отверждения адгезивов морских обрастателей. Состав адгезива имеет белковую природу, сшивание молекул белка происходит производными фенола о-хиноном в присутствии кислорода. Фермент катехолоксидаза катализирует окисление пептидил-3,4-дигидроксифенилаланина в пептидил-3,4-дигидроксифенилаланинхинон. Одновременно белок связывается с гидроксилами твердой поверхности. Далее пептидил-3,4-дигидроксифенилаланинхинон взаимодействует с пептидиллизином или другим пептидом с концевой нуклеофильной аминогруппой. В результате две белковых молекулы сшиваются, а образовавшийся белковый комплекс способен к повторению цикла сшивки.
Асцидии
Асцидии относятся к морским организмам, которые могут вести как одиночный образ жизни, так и образовывать колонии. Они находятся обычно в тенистых водах и прикрепляются к твердым поверхностям путем адгезии, а реже зацепляются столонами за осадок на мягком дне. Большая часть одиночных асцидий является яйценосными, а колониальные – почти всегда живородящие или яйцеживородящие (развитие вылупившегося из яйца организма происходит в теле родителя). Все личинки асцидий являются лецитотрофными, т. е. питаются желтком или другими запасами, но не могут питаться самостоятельно до начала стадии метаморфозы. Они живут короткое время – от нескольких часов до нескольких дней, что зависит как от вида, так и окружающих условий.

Структуру личинок асцидий можно разделить на три группы органы первой категории обеспечивают движение личинки, сенсорные функции и адгезию, они быстро разрушаются после прикрепления; органы второй группы становятся функциональными в ювенильной (начальной взрослой) стадии. Последняя группа имеет структуры первых двух и частично послеличиночного цикла.
Личинки одиночных асцидий имеют длину 0,6-1,5 мм, простые адгезивные присоски и изредка вторичные органы для адгезии. В них имеются зачатки органов взрослых особей – пищевод, желудок, сифоны, атриум, сердце. Клетки гладких мышц и кровяные клетки не полностью дифференцированы. Хорда имеет относительно жесткую структуру и состоит примерно из 40 эпителиальных клеток в одном слое вокруг центрального ядра матрицы. Базальная пластина и нитевидная оболочка образуют внешнюю поверхность. Хвост состоит из 36 мышечных клеток в три ряда с каждой стороны хорды. Личинки всегда заключены в два прозрачных кутикулярных слоя туники. Внешний слой отбрасывается при метаморфозе. Личинки колониальных асцидий имеют ту же структуру, но их органы более сложные, а будущие взрослые органы более дифференцированы. Образцы различных личинок асцидий приведены на рис. 17.
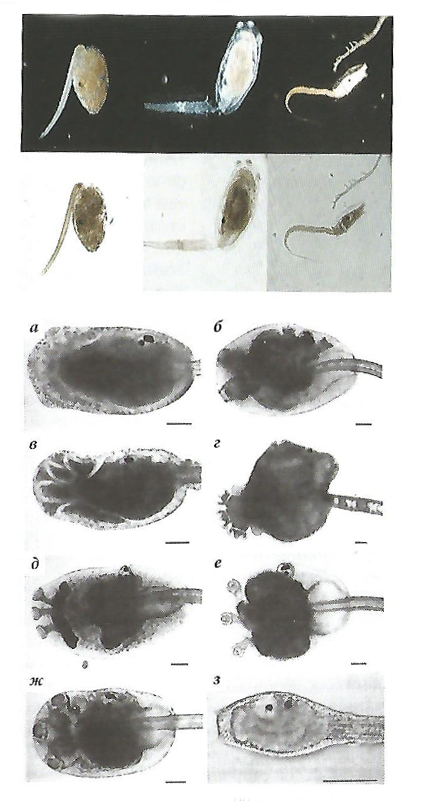
а – Aplidium cafifornicum (Polycitoridae); б – Distaplia accidentalis (Polycitoridae); в – Eudistoma olivaceum (Polycitoridae); г – Ecleinascidia turbinate (Perophoridae); д – Cystodytes lobatus (Policitoridae); e – Diplosoma nmcdonaldi (Didemnidac); ж – Eudistoma Ritteri (Polycitoridae); з – Boltenia villosa (Pyuridae)
У асцидий примитивных видов адгезивная жидкость находится в специфических ампулах, рассеянных по всему телу. При выделении адгезива вся поверхность их тела становится липкой, что обеспечивает возможность прилипания к выбранной поверхности. Но у многих личинок асцидий имеются специальные адгезивные папиллы или присоски. Личинки Dislarplia occidentalis (Polycitoridae) (рис. 17, в и рис. 18) представляют собой наиболее сложный вид этой группы. Все органы этих личинок, включая гладкие мышцы стенки тела и многие кровяные клетки, прекрасно дифференцированы. Присоски имеют сложную структуру шапочек и быстро выворачиваются наружу, когда начинается осаждение. На рис. 18 схематически представлено строение этой личинки.
Читайте также: Классификация современных кораблей, судов и их устройство
У большинства личинок асцидий – три адгезивных сосочка в передней части туловища, некоторые имеют только два. Личинки производят адгезивное вещество в начальной фазе своего осаждения. Существует два основных типа сосочков: выворачивающиеся и невыворачивающиеся. Выворачивание происходит путем сокращения 260 миоэпиталиальных клеток, которые расстилаются от края до основания сосочка. Все три сосочка выворачиваются одновременно на стадии метаморфоза, это происходит примерно за 30 с при 14 °С. Миоэпитальные клетки сокращаются примерно до 1/3 длины, центральная часть сосочка продвигается до 60-70 мкм, раскрывая адгезив. В конце процесса сосочки втягиваются, приближая осаждающуюся личинку ближе к субстрату.
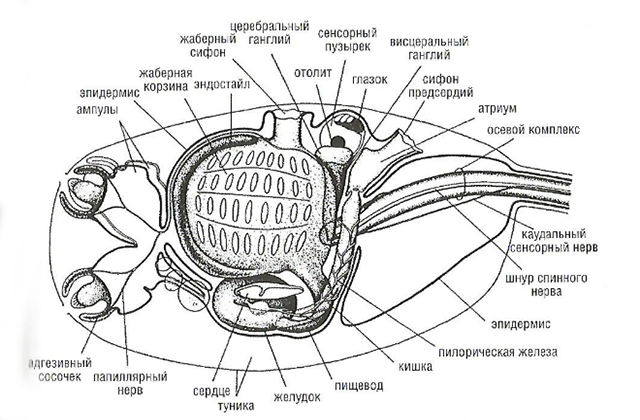
Личинки асцидий реагируют на свет и силу тяжести. Одиночные личинки, после того как покидают родительскую колонию, избегают света, предпочитая плавать в затененных или темных местах. При этом колебания интенсивности света, с одной стороны, стимулируют личинки к плаванию, а с другой – сокращают процесс свободного плавания. Личинки Distaplia accidetitalis во время свободного плавания обнаруживают геонегативную и фотопозитивную реакции и обычно оседают около ватерлинии судна на самых освещенных местах. Несмотря на фотопозитивность личинок, если им предоставляется выбор, например контрасты светлых и темных полос, то они оседают в 90 % случаев на темных участках. Личинка плавает около ватерлинии и ищет темные места, но обычно от источника света они не уплывают (например, если они находятся на освещенной стороне поверхности, на которой должны осесть).
Личинки асцидий другого типа Chelyosoma productum не обнаруживают гео- или фотозависимости и не проявляют предпочтений к свету при осаждении. Большинство личинок этого вида оседает на днищах или на субстратах, смежных с уже осевшими молодыми особями.
Изменения в структуре личинки, приводящие к ее превращению в ювенильную особь, начинаются с питания и роста. Временные органы личинки разрушаются и удаляются фагоцитами. Ювенильные органы становятся функциональными. Этот период продолжается минуты и часы у сложных асцидий и от нескольких дней до недели у одиночных асцидий.
Метаморфоз асцидий проходит следующие стадии:
- секреция адгезива сосочками (или эпидермисом тела у других видов);
- выворачивание сосочков и их отвод;
- потеря хвоста;
- потеря внешнего кутикулярного слоя туники (включая плавники);
- эмиграция кровяных клеток в тунику или движение кровяных клеток или пигментных клеток внутрь туники;
- ротация висцеральных органов, расширение жаберной корзины;
- расширение, удлинение или рост ампул, расширение туники;
- втягивание сенсорных пузырьков;
- фагоцитоз временных органов тела личинки и хвоста;
- освобождение будущих ювенильных органов от сдерживания развития.
Мшанки (Bryozoans)
Мшанки или бриозоны являются важными компонентами обрастающей колонии. Они покрывают корой различные погруженные в морскую воду объекты и наносят большой ущерб вследствие огромной способности к воспроизводству. Новые достижения лабораторной техники позволили тщательно изучить процесс их осаждения. При исследовании уделяли внимание как физической характеристике поверхности, так и роли бактериальной пленки при осаждении, а также развитию макроорганизмов колонии. Род мшанок огромен: он состоит примерно из 4 000 колоний и преобладающих сидячих организмов.
Их можно обнаружить в пресной и морской воде. Начало колонии дают личинки – цифонауты, превращающиеся при метаморфозе в ансеструлу, которая размножается почкованием и начинает рост колонии.
Род Bugula, класс Gymnolaemata, семейство Cellularioidea состоит из множества видов, встречающихся повсеместно. Их легко идентифицировать, так как они напоминают кусты, а их высота составляет от нескольких миллиметров до более 10 см, что зависит и от вида, и от окружающих условий (рис. 19).
В каждой колонии имеются разные полиморфные индивиды, из них только способные питаться производят половые клетки (гаметы). Развитие эмбрионов происходит в сложной племенной камере. В результате эмбрионального периода образуются личинки и освобождаются при увеличении интенсивности света. Личинки являются непитающимися и свободно плавают только в течение нескольких часов до фазы осаждения и метаморфоза (рис. 20).

Поведение личинок разных типов отличается, но в основном оно делится на две фазы: свободное плавание и выбор субстрата. Вначале реакции организма личинки зависят от температуры и не зависят от количества света. Предполагается, что светочувствительными (фоторецепторами) являются сенсорные структуры эпидермиса. Во второй фазе поисков субстрата личинки плавают кругами, постепенно сужая их, над местом выбранной посадки на субстрате; они «испытывают» субстрат с помощью длинного пучка ресничек. Эффективные движения этих ресничек проходят вначале над субстратом и затем по желобкам с большим количеством ресничек передаются на переднюю поверхность личинки. Во время этого исследования личинка часто временно пристает к поверхности субстрата, но может нарушать эту связь и продолжать исследование. Предполагается, что для временного прикрепления выделяется слизь из особого «тестирующего» грушевидного органа, а при откреплении реснички способствуют уменьшению вязкости этой слизи, создавая нужные усилия. Метаморфоз личинок проходит в две стадии: вначале быстрая последовательность морфогенетических изменений и затем более долгий период гистолиза и гистогенеза. С момента осаждения начинается ряд радикальных преобразований ткани. Во время оседания выворачивается метасоматический мешок, покрытый эпидермисом личинки (рис. 21).
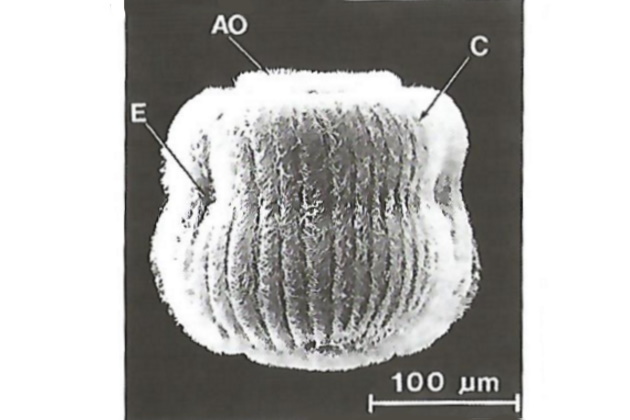
АО – верхушечный орган; С – коронка (орган передвижения личинки); В – предполагаемый фоторецептор
Взаимодействие между субстратом и областью крышки метасоматического мешка перманентно и необратимо и представляет собой главный морфогенетический акт метаморфоза. Весь процесс метаморфоза у показанной личинки длится примерно 20 мин. Метаморфоз дополняется рядом относительно медленных гистогенных процессов, в результате которых происходят изменения ткани. Метаморфоз можно считать законченным, когда особь имеет пищеварительный тракт и начинает питаться. Весь процесс метаморфоза занимает у личинок мшанок в зависимости от вида 1-10 сут.
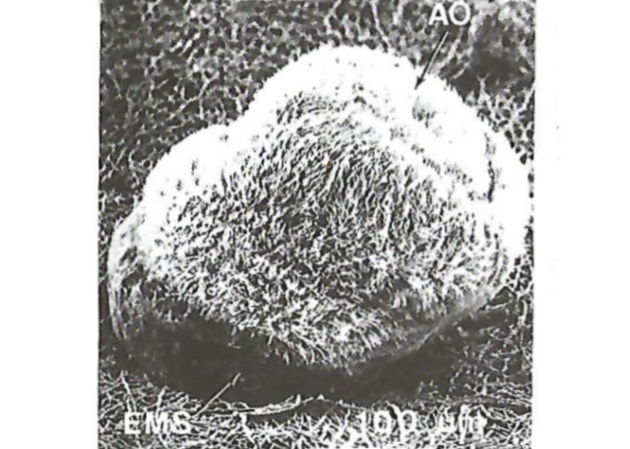
АО – верхушечный орган; EMS – метасоматический мешок
Для осаждения личинок большую роль играет состояние поверхности, в основном ее гидрофильность или гидрофобность. Исследования показали, что наличие адсорбированной поверхностью органической пленки не влияет на осаждение личинок, о влиянии бактериальной пленки четкие данные отсутствуют, хотя в ходе исследований собран интересный материал. Оказалось, что личинки определенных видов мшанок имеют симбиозные бактерии, ассоциированные с ними. Эти бактерии освобождаются и образуют облако над поверхностью во время ранней морфогенетической стадии метаморфоза. Ассоциации таких бактерий не связаны с местом локации, годом или сезоном, но зависят от вида личинок. Наиболее распространенные Bugula neritina имеют бактерии внутри складок пазухи эпителия мантии. Этот вид мшанок первым колонизируется на субстрате.
Предлагается к прочтению: Разборка судовых технических средств
Когда бактерии освобождаются при метаморфозе, они могут создавать условия на субстрате и содействовать осаждению личинок того же вида, других видов мшанок или личинок других морских организмов.
