Накипеобразование в судовых испарителях морской воды является распространенной проблемой, связанной с осаждением минеральных отложений на их поверхности. Это может происходить из-за высокой концентрации солей и минералов, содержащихся в морской воде. Накипь ухудшает эффективность теплообмена, уменьшает производительность оборудования и может привести к его повреждению.
О влиянии накипи на работу испарителя можно судить по важнейшей характеристике – производительности, которая при неизменном давлении греющего пара в испарителях избыточного давления понижается в два-три раза за 100-120 ч работы вследствие теплового сопротивления слоя накипи, удаление которого в подобных испарителях производится вручную. В связи с этим на многих старых судах такие испарители практически не использовались по прямому назначению, а служили лишь для получения добавочной котельной воды путем дистилляции пресной береговой воды.
- Исследование накипеобразования в испарителях. Состав и свойства накипи
- Механизм процесса накипеобразования в испарителях морской воды
- Количество накипи в различных условиях испарения морской воды
- Потенциальное количество накипи
- Реальное количество накипи в зависимости от основных конструктивных и эксплуатационных факторов
- Снижение температурного сопротивления накипи в испарителях морской воды
- Расчет термического сопротивления при накипеобразовании в испарителях морской воды
Проблема накипеобразования менее остра для глубоковакуумных опреснителей, но здесь ее решение достигается достаточно дорогой ценой – путем усложнения состава установки и значительного увеличения поверхностей конденсатора и испарителя.
Попыткам уменьшить эти поверхности путем интенсификации теплообмена, препятствует все возрастающая интенсивность отложения накипи по мере увеличения тепловых потоков.
Поэтому не будет преувеличением сказать, что и до сих пор накипеобразование – главный тормоз на пути усовершенствования опреснительных установок (уменьшения их размеров и стоимости, увеличения экономичности и упрощения обслуживания). Несмотря на то что найдено немало эффективных методов снижения накипеобразования, проблема не может считаться решенной, так как каждый из этих методов имеет свои недостатки и пригоден только для определенных условий. Поэтому основной задачей проектирования и эксплуатации опреснителей в рассматриваемом аспекте остается создание и поддержание таких режимов работы опреснителя, при которых отложение накипи было бы минимальным, а его последствия – наименее неблагоприятными.
Исследование накипеобразования в испарителях. Состав и свойства накипи
Представление о процессе накипеобразования в основном сложилось на базе предположительной схемы его механизма, развитой Холлом, Партриджем и Отто. Эти авторы объясняли процесс образования накипи безостановочным испарением колечка воды, заключенного между пузырьком и поверхностью нагрева.
Дальнейшее развитие теория Холла получила в СССР в работах М. Я. Полянского, Ю. М. Кострикина, Д. А. Розенеля и др. Согласно этой теории пузырек пара, покидая поверхность нагрева, оставляет на ней след от отложения всех загрязнений, находящихся в перегретой воде, превратившейся в пар.
Пытаясь объяснить механизм выпадения в твердый осадок таких легкорастворимых солей, как NaCl, Na2SO4 и даже Na(OH), Холл утверждал, что при выпаривании воды в кольцевой пленке на границе пар – жидкость – поверхность нагрева концентрация всех солей достигает предела насыщения.
Согласно современным представлениям о механизме процесса ядерного кипения существует ряд положений, противоречащих теории накипеобразования Холла.
В действительности в процессе контактного роста паровая ножка пузырька весьма тонка (доли мм), отрывной диаметр его мал (обычно меньше 1 мм), а частота генерации составляет ~50 пузырьков в секунду. Примыкающее к паровому пузырьку колечко рассола на границе пар – жидкость – поверхность теплообмена за счет сброса теплоты перегрева жидкости внутрь пузырька при его контактном росте имеет наименьшую (а не наибольшую, как утверждал Холл) температуру в граничном слое.
Маловероятно также предположение Холла о перегреве участка поверхности теплообмена непосредственно под паровой ножкой пузырька из-за малого ее сечения, высокой теплопроводности металла поверхности теплообмена и высокой цикличности генерации паровых пузырьков. Не объясняет теория Холла и накипеобразования на необогреваемых поверхностях.
После опубликования в 1952 г. работы Хильера представления о механизме процесса накипеобразования в судовых испарителях морской воды несколько расширились. Хильер предполагает, что накипеобразование обусловливается силами притяжения электронов и когезией и что скорость образования накипи, вероятно, пропорциональна степени активности ионов на поверхности, где образуется накипь.
Количество накипи пропорционально числу ударов, совершаемых накипеобразующими элементами о поверхность, так как в твердом состоянии эти элементы электрически нейтральны, а в виде ионов они несут электрические заряды, которые создают силы притяжения, необходимые для адгезии ионов к поверхности. По Хильеру всякая поверхность постоянно находится в состоянии электрического неравновесия, имея локальные положительные и отрицательные электрические заряды, так что она может поглощать как отрицательные, так и положительные ионы при их контакте с погруженной в жидкость поверхностью.
Изменяющуюся интенсивность процесса накипеобразования с изменением тепловых условий работы судового испарителя Хильер объясняет тем, что при нагреве скорость движения ионов увеличивается, а значит возрастает и число ударов о поверхность за определенный промежуток времени, т. е. увеличивается скорость образования накипи. При испарении, когда образуются пузырьки пара, происходит концентрация накипеобразующих элементов по периметру контакта пузырьков пара с поверхностью нагрева. Это усиливает ионную активность окружающей жидкости и способствует дальнейшему ускорению роста накипи.
Теория смешанных зарядов на поверхности, выдвигаемая Хильером, не согласуется с современными представлениями об адсорбции на поверхности раздела.
Исследования, проведенные Хильером, Пивером, Бьянуччи, Ланжелье, Эллиотом и др., показали, что в зависимости от теплофизических условий работы судовых испарителей морской воды в них может образоваться накипь в основном трех типов:
- углекислый кальций;
- гидроокись магния;
- сульфат кальция.
Углекислый кальции CaCO3 и гидроокись магния Mg(OH)2 образуются в результате разложения двууглекислого кальция Ca(CO3)2 с выделением CO2.
Бикарбонаты и карбонаты кальция в морской воде полностью ионизированы
При нагреве и испарении морской воды парциальное давление CO2 в воде уменьшается; ионы бикарбонатов распадаются на ионы карбонатов, воду и газ CO2, выделяющийся из воды при кипении. Происходят следующие ведущие к образованию накипи реакции:
Если рассол кипит при температуре ниже 79 °С, то за счет испарения воды повышается концентрация ионов карбонатов, и некоторые ионы карбонатов соединяются с ионами кальция, вследствие чего из раствора выпадает CaCO3,
Углекислый кальций может оставаться в растворе во взвешенном состоянии в виде суспензии (шлама) и может отлагаться в виде накипи. При более высоких температурах (выше 80 °С) начинается распад карбонатных ионов с образованием гидроксильных ионов, которые в соединении с ионами магния образуют гидроокись, выпадающую в виде накипи,
Гидроокись магния при температурах до 82-83 °C остается в рассоле в виде суспензии, интенсивно выпадая на всех поверхностях (обогреваемых и необогреваемых) при дальнейшем повышении температуры. Согласно исследованиям накипеобразование в судовых испарителях морской воды рассматривается не как цикличный процесс выпадения всего сухого состава из воды при образовании паровых пузырьков (по Холлу) и не как эффект электрического неравновесия поверхностей, имеющих локальные положительные и отрицательные электрические заряды (по Хильеру), а как весьма сложный электрохимический процесс кристаллизации, обусловливаемый рядом физико-химических и тепломеханических факторов.
В определенном смысле накипеобразование можно уподобить процессу гальваностегии. Как при гальваностегии количество и структура металла покрытия – функция плотности тока, концентрации электролита и его температуры, так при накипеобразовании количество и структура образующейся накипи – функция величины теплового потока (или температурного напора), концентрации и температуры кипящего рассола.
При ядерном кипении в перегретом граничном слое разрушаются сольваты и ионы солей соединяются в кристаллики накипи, которые затем укрупняются и разрастаются. Каждый из этих процессов протекает с определенной скоростью в зависимости от нескольких определяющих факторов. Преобладает тот или другой процесс и соответственно получается та или иная структура накипи (мелко-, средне- или крупнозернистая). Механизм этого процесса еще больше усложняется в связи с изменением химического состава образующейся накипи при изменении концентрации и температуры кипящего рассола морской воды.
По результатам исследования ОВИМУ при неизменной температуре кипения и меняющейся концентрации рассола в судовом испарителе морской воды можно получить рыхлую порошкообразную, пористую твердую, либо, наконец, очень плотную твердую накипь. Соответственно меняются теплофизические и механические свойства накипи, что решающим образом влияет на приращение ее термического сопротивления при работе судового испарителя, трудоемкость и эффективность ее удаления с поверхностей нагрева.
Известно, что устойчивость работы судовых испарителей морской воды во многом зависит от накипеобразования, происходящего на их греющих поверхностях.
Характер и скорость нарастания накипи на греющих поверхностях определяют условия теплопередачи, изменение (уменьшение):
- коэффициента теплопередачи K в ккал/(м2 · ч · град);
- и соответственно производительности испарителя W2 в кг/ч.
Общее термическое сопротивление накипи R, образующейся в судовых испарителях, зависит от ряда переменных факторов, что не позволяет нормировать его численные значения. Однако можно определить несколько величин, влияющих на R, и по этим величинам найти искомое термическое сопротивление.
Это и послужило основанием для проведения исследований по определению закономерностей изменения:
- коэффициента теплопередачи K в зависимости от времени работы испарителя τ в ч;
- рабочей концентрации рассола B в %;
- температурного напора ∆t в град;
- давления вторичного пара p2 в кГ/см2.
Такие исследования проводились на Современные транспортные суда различного назначенияпассажирских и транспортных судах Черноморского морского пароходства и китобойной базе «Советская Украина», а также на специальном заводском испытательном стенде.
В качестве примера ниже приведены результаты испытаний испарителя ИВС-3К на стенде. Контрольные исследования накипей, полученных в одинаковых условиях на океанской и черноморской воде, дали удовлетворительно сходящиеся результаты. В связи с этим результаты описываемых исследований можно рассматривать хотя бы в первом приближении как достаточные для формирования некоторых выводов.
Параметры этапов и режимов этих испытаний приведены в таблице 1.
| Таблица 1. Параметры этапов и режимов испытании испарителя ИВС-3К | ||||||||
|---|---|---|---|---|---|---|---|---|
| Этапы | Режимы | Параметры | ||||||
| p1, кГ/см2 | t1, °С | p2, кГ/см2 | t2, °С | ∆t, град | tп. в, °С | В, % | ||
| Первый | а | 3,0 | 133 | 1,5 | 111 | 22 | 70 | 5 |
| б | 3,0 | 133 | 1,5 | 111 | 22 | 70 | 7 | |
| в | 3,0 | 133 | 1,5 | 111 | 22 | 70 | 9 | |
| г | 3,0 | 133 | 1,5 | 111 | 22 | 70 | 11 | |
| Второй | д | 0,8 | 93 | 0,35 | 72 | 21 | 50 | 5 |
| е | 0,8 | 93 | 0,35 | 72 | 21 | 50 | 7 | |
| ж | 0,8 | 93 | 0,35 | 72 | 21 | 50 | 9 | |
| Третий | з | 1,4 | 109 | 0,35 | 72 | 37 | 50 | 5 |
| и | 1,4 | 109 | 0,35 | 72 | 37 | 50 | 7 | |
| к | 1,4 | 109 | 0,35 | 72 | 37 | 50 | 9 | |
Змеевики батареи по окончании десятисуточных режимов работы оказывались покрытыми равномерным слоем плотной накипи различной толщины в разных режимах (от 0,8 до 1,4 мм). Удельные веса образующейся накипи составляла 2 300-2 700 мг/см3, а коэффициенты теплопроводности образующейся накипи – 0,47 ÷ 1,26 ккал/(м·ч·град). Изменения значений коэффициентов теплопередачи во времени десятисуточных режимов (а – к) испытаний приведены на рис. 1.
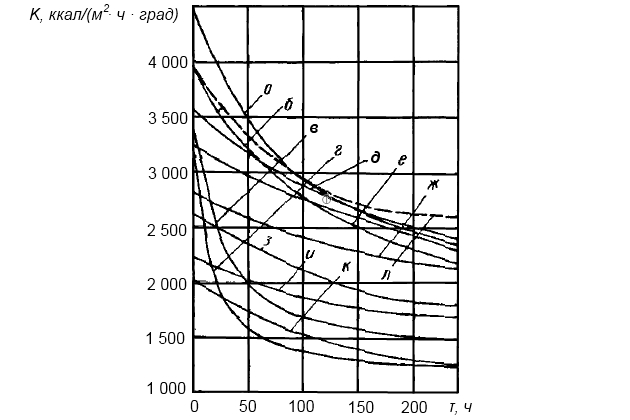
В зависимости от условий работы испарителей морской воды на их поверхностях нагрева может образовываться различная по химическому составу, структуре и свойствам накипь с различной плотностью и теплопроводностью. По данным испытаний Хильера на греющих поверхностях опытного испарителя образовывалась накипь, в состав которой в различных пропорциях входили:
- CaCO3;
- Mg(OH)2;
- CaSO4.
Причем при температурах кипения ниже 80 °С в накипи было больше CaCO3, а при температурах кипения выше 80 °С основным компонентом в накипи был Mg(OH)2.
Приведенная Хильером зависимость по составу накипи справедлива для конкретных условий:
- температурных напоров ∆t = 16 – 53 град;
- температуры кипения t2 = 71 °С;
- постоянной концентрации рассола B = 6,5 %.
Данные, характеризующие состав накипи при других возможных в практике эксплуатации концентрациях рассола, отсутствуют.
Необходимость таких данных обусловливается тем, что соотношение компонентов в составе накипи определяет ее теплофизические свойства:
- плотность;
- теплопроводность;
- термическое сопротивление.
Существующие рекомендации по выбору коэффициента теплопроводности накипи в очень широком диапазоне ее численных значений – λ = 0,1 ÷ 5 ккал/(м·ч·град) – нельзя признать удовлетворительными. Расчет теплопередачи для чистой поверхности нагрева с учетом накипеобразования введением поправочных коэффициентов β = 0,75 ÷ 0,9 нельзя считать правильным, поскольку тепловое сопротивление слоя накипи и его толщина меняются в очень широких пределах.
Опасность в смысле накипеобразования представляют соли с отрицательным температурным коэффициентом растворимости. Океанская вода (табл. 2) находится на пределе насыщения ионами, образующими при своем соединении карбонат кальция, поэтому карбонатная накипь – главная составляющая накипи во всех низкотемпературных испарителях.
| Таблица 2. Удельный вес и солесодержание в различных бассейнах | |||
|---|---|---|---|
| Бассейн | Удельный вес, т/м3 | Солесодержание, % | |
| Белое море: | в горле | 1,019 ÷ 1,021 | 3,3 |
| в средней части | 2,5 ÷ 2,6 | ||
| в Двинском заливе | 0,1 | ||
| Балтийское море: | в Ботническом заливе | 1 ÷ 1,006 | 0,2 ÷ 0,5 |
| в Финском заливе | 0,2 ÷ 0,4 | ||
| Гогланд и Аландские острова | 1,01 ÷ 1,016 | 0,6 ÷ 0,67 | |
| в проливе Бельт | 1 ÷ 2,2 | ||
| Черное море: | северо-западная часть | 1,015 ÷ 1,018 | 1,7 |
| средняя и южная часть | 1,85 | ||
| Каспийское море: | в середине | – | 1 ÷ 1,5 |
| вдоль берега | – | 1 ÷ 1 | |
| Мраморное море: | у Босфора | – | 2 ÷ 2,1 |
| у Дарданелл | – | 2,4 ÷ 2,5 | |
| Азовское море | – | 0,93 ÷ 1,2 | |
| Средиземное море | – | до 4,1 | |
| Красное море | – | до 4,1 | |
| Японское море | – | 3,4 | |
| Немецкое море | – | 3,4 | |
| Северный Ледовитый океан | 1,024 ÷ 1,025 | 3,5 | |
| Атлантический океан | 1,025 ÷ 1,027 | 3,5 ÷ 3,79 | |
| Индийский океан | 1,025 ÷ 1,032 | 3,2 ÷ 3,75 | |
| Тихий океан | 1,025 ÷ 1,032 | 3,4 ÷ 3,69 | |
При температуре кипения морской воды выше 80 °С накипь преимущественно состоит из Mg(OH)2. Выпадению Mg(OH)2 способствует избыток ионов OH–, которые появляются в растворе при повышенных температурах вследствие разложения (из-за ударов при интенсивном молекулярном движении) бикарбонатных соединений на ионы OH– и молекулы CO2 и снижения концентрации ионов CO3
Соль CaSO4, имеющая отрицательный коэффициент растворимости, образует твердую накипь, обладающую также свойством цементировать рыхлые осадки прочих солей и шлама, удерживая их таким образом в накипи.
Для выяснения солевого состава и теплофизических свойств накипи, образующейся при различных режимах работы испарительной установки, были проведены натурные испытания испарителя ИВС-3К и лабораторные исследования накипи, образовавшейся на его греющих поверхностях.
Параметры десяти режимов работы испарительной установки продолжительностью по 240 ч приведены в таблице 1.
Определение значений коэффициентов теплопроводности накипи, образовавшейся при различных режимах работы испарителя, проводилось опытным путем на специальных лабораторных установках стационарного и нестационарного теплового режима. В экспериментальной установке для определения теплопроводности накипи при стационарном тепловом режиме моделировались натурные условия: накипь находилась в рассоле морской воды с концентрацией, равной той, при которой происходило ее образование в испарителе, и исследовалась при тех же температурных напорах, что и в соответствующих режимах работы испарителя ИВС-3К.
Результаты исследований теплопроводности накипи испарителя ИВС-3К на установке стационарного теплового режима в условиях, близких к натурным, показаны на рис. 2.
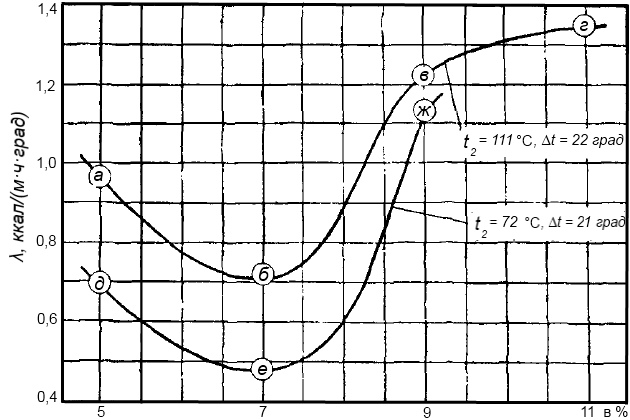
Характер изменений теплопроводности накипи, определяемой по методу нестационарного теплового режима (рис. 3), качественно сходен с полученным в опытах на установке стационарного теплового режима, но численные ее значения для различных накипей оказываются меньше на 5-30 %.
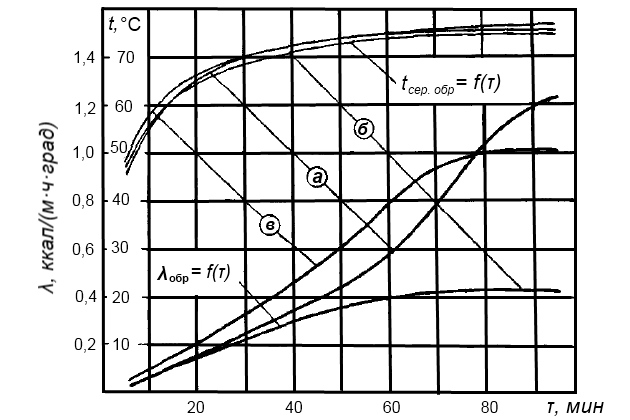
Это объясняется невозможностью получения в пресс-форме испытываемого образца, плотность которого совпадала бы с той, которую имеет накипь в естественных условиях.
Так, характер изменения λ во времени опытов, когда исследовались образцы влажной накипи трех режимов (з, и, к) третьего этапа испытаний ИВС-3К (см. табл. 1) показывает, что наиболее теплопроводной оказалась накипь, образовавшаяся при рабочей концентрации рассола в корпусе испарителя 9 %. Наименьшую теплопроводность имеет накипь, образовавшаяся при концентрации рассола 7 %. Кривые tсер. обр = f(τ) отражают характер изменения температуры середины образца испытываемой накипи во времени опыта.
Контрольные исследования, проведенные на лабораторных установках стационарного и нестационарного тепловых режимов, показали, что теплопроводность сухих накипей в 2,5-3 раза ниже, чем влажных, причем характер изменений численных значений теплопроводности сухих накипей качественно подобен приведенному на рисунке 2 характеру изменения для влажных накипей.
На основании расчета теплопередачи каждого из десяти режимов работы ИВС-3К (см. табл. 1) найдены расчетные значения теплопроводности образующихся в этих режимах накипей
где:
- δн – средняя толщина слоя накипи на змеевиках греющей батареи в конце десятисуточного режима, м;
- ∆Rр – расчетное приращение термического сопротивления теплопередачи в режиме с накипеобразованием, определяемое по формуле
где:
- Kк в ккал/(м2 · ч · град) и Kн в ккал/(м2 · ч · град) – расчетные коэффициенты теплопередачи конечных и начальных шести часов работы испарителя.
Значения Kк и Kн определяются на основании уравнения теплового баланса
где:
- G1 – расход греющего пара, кг/ч;
- i1 и i2 – теплосодержание греющего пара и его конденсата, ккал/кг;
- t1 и t2 – температуры греющего и вторичного пара, °C;
- F – площадь греющей поверхности батареи, м2.
Расчетные значения теплопроводности накипи сходны со значениями, полученными на экспериментальной установке стационарного режима.
Для определения состава исследуемых накипей проводили их рентгеновский анализ на установке УРС-70 в хромовом излучении. Качественный фазовый анализ показал присутствие в накипях:
- Mg(OH)2,
- CaSO4,
- CaCO3,
- Ca(OH)2.
Результаты количественного анализа представлены на рис. 4.
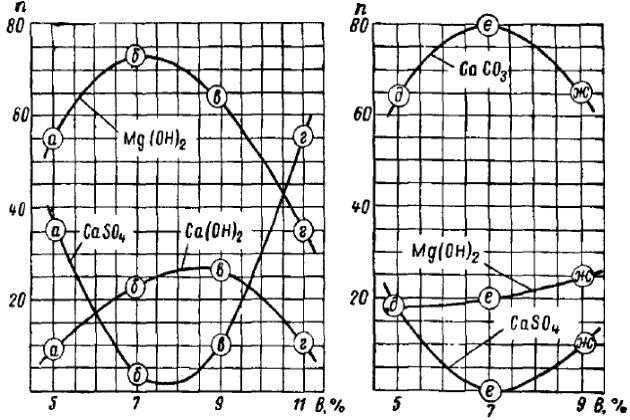
Из графиков (рис. 4) видно, что при высоких температурах кипения (111 °С) в режимах первого этапа испытаний (а, б, в, г) образуется в основном магниевая накипь, а при пониженных температурах кипения (72 °С) в режимах второго этапа испытаний (д, е, ж) образуется накипь с преимущественным содержанием карбоната Ca и гидроокиси Mg. Изменение концентрации приводит к заметному изменению количественного соотношения компонентов в накипях. Выпадение CaSO4 при высокой температуре кипения (в первом режиме первого этапа испытаний) – следствие его отрицательного коэффициента растворимости.
При повышении концентрации рассола до 7 и 9 % (во втором и третьем режимах первого этапа испытаний) в кипящем рассоле возрастает количество ионов Na′ и Cl′, что повышает растворимость ангидрита. Интенсивное выпадение его в накипь при концентрации рассола 11 % объясняется переходом предела насыщения для CaSO4 при соответствующих теплофизических условиях работы испарителя.
Высокая температура кипения рассола в режимах первого этапа (а, б, в, г) способствует интенсивному разложению находящихся в морской воде карбонатов CaCO3 и бикарбонатов Ca(HCO3)2 с образованием избытка гидроксила OH′, что приводит к выпадению в накипь не только Mg(OH)2, но и Ca(OH)2.
При пониженной температуре кипения в режимах второго этапа (д, е, ж) Ca(OH)2 в накипях не обнаруживается. При изменении рабочей концентрации рассола характер изменения содержания CaCO3 и CaSO4 в накипях второго этапа испытаний (д, е, ж), отличаясь количественно, оказывается качественно сходным с соответствующими изменениями в режимах первого этапа (а, б, в, г).
Таким образом, можно сделать вывод, что температура кипения рассола определяет качественный состав образующейся накипи, а изменение концентрации кипящего рассола приводит к изменению количественных соотношений солей, входящих в накипь, при данной температуре кипения Эти данные показывают характер образования накипи в условиях стенда, где солевой состав воды несколько отличается от солевого состава воды мирового океана, и потому они носят приближенный характер.x.
Механизм процесса накипеобразования в испарителях морской воды
Данные, полученные при испытаниях ряда испарителей, показывают, что с увеличением концентрации кипящего рассола численное значение коэффициента теплопередачи K для чистой поверхности теплообмена снижается, а накипь становится более плотной, теплопроводной и хрупкой. При повышении концентрации от 5,5 ÷ 6 до 9-11 % скорость накипеобразования (имеется в виду толщина образующейся накипи) уменьшается.
Теплопроводность накипи, состоящей из CaCO3, меньше, чем теплопроводность накипи, состоящей из Mg(OH)2. Наибольшую теплопроводность имеет накипь, состоящая из
Интенсивность образования и химический состав накипи определяются скоростью образования гидроксильных и карбонатных ионов. Эти две реакции происходят в испарителе одновременно. При температуре ниже 80 °С скорость образования карбонатных ионов из бикарбонатных солей больше, чем скорость образования гидроксильных ионов. Вследствие этого концентрация карбонатных ионов повышается настолько, что образуется накипь из карбоната кальция.
При температуре выше 80 °С скорость образования гидроксильных ионов высокая, что снижает концентрацию карбонатных ионов в рассоле. Концентрация гидроксильных ионов ограничивается произведением растворимости водной окиси магния и может возрастать лишь до начала образования твердой водной окиси магния.
Важная проблема накипеобразования в испарителях морской воды – исследование причин, вызывающих при известных условиях переход от накипи CaCO3 к накипи из Mg(OH)2 и накипи из
где:
- m = 0,5 или 2.
Для объяснения этой проблемы выдвигается предположение о том, что ход химических реакций в испарителе протекает в такой последовательности, развивающейся из исходной реакции (формула 3):
Эту реакцию можно рассматривать как гидролиз карбонатных
ионов
Исходя из формулы 5, можно объединить все химические реакции, относящиеся к образованию накипи из CaCO3 и Mg(OH)2, в одно уравнение
В это сложное уравнение объединены четыре самостоятельные реакции, тесно связанные одна с другой. Реакция (1) представляет собой термический распад ионов бикарбоната и ею определяется образование накипи. До осаждения кристалла накипи CaCO3 или Mg(OH)2 должен произойти термический распад двух ионов бикарбоната. В условиях работы испарителя морской воды – это необратимая реакция, так как освобождающийся CO2 уходит вместе с паром. Скорость термического распада возрастает с повышением температуры. Протекание реакции (2) зависит от произведения растворимости CaCO3 и для его осаждения в накипь эта величина должна быть превышена, т. е.
должно быть больше произведения растворимости. Точно так же протекание реакции (3) зависит от произведения растворимости Mg(OH)2, а произведение
должно быть больше произведения растворимости Mg(OH)2 в концентрированном рассоле до начала осаждения.
Реакция (4) показывает, что термический распад ионов в условиях работы испарительной установки необратим. С превышением произведения растворимости CaCO3 ионы карбоната начинают непрерывно выделяться из раствора, в результате чего ограничивается их концентрация.
Таким образом, силы, действующие при гидролизе карбонатных ионов в ионы гидроксила, очень малы. Применяя закон действия масс к реакциям гидролиза карбонатных ионов, получим
где:
- Kh – постоянная гидролиза.
здесь:
- Kw – постоянная диссоциация воды;
- K2 – постоянная вторичной диссоциации угольной кислоты.
С повышением температуры изменение значений Kw и K2 определяет значительное увеличение постоянной Kh. В этом случае концентрация карбонатных ионов уменьшается, а требование произведения растворимости карбоната кальция больше не удовлетворяется; следовательно, образование CaCO3 прекращается. В то же время количество ионов бикарбоната и гидроксила увеличивается, и как только произведение растворимости Mg(OH)2 достигает соответствующего значения, начинает образовываться накипь из Mg(OH)2.
Образование сульфатной накипи CaSO4 вначале при малых, а затем только при весьма высоких концентрациях раствора предположительно может быть объяснено тем, что растворимость сульфата кальция (а возможно и водной окиси магния и даже карбоната кальция) значительно повышается в концентрированных растворах хлористого натрия.
Можно предположить, что с увеличением концентрации рассола в испарителе Особенности коррозии в морской и пресной водеморской воды (и прежде всего при повышении концентрации NaCl) возникают комплексные образования солей и уменьшается концентрация свободных ионов накипеобразователей за счет создания растворимых сульфатных, а возможно и гидроксильных и даже карбонатных комплексов. При наличии таких комплексов концентрация свободных ионов накипеобразователей поддерживается на таком уровне, что постоянная их растворимости не превышается, и они остаются в растворе.
Вероятно, ионы Na образуют с ионами SO4 комплекс (существование которого возможно только в растворе), достаточно прочный, чтобы увеличить растворимость CaSO4 в присутствии NaCl по сравнению с его растворимостью в чистой воде. Повышенная растворимость солей жесткости в присутствии NaCl предположительно может быть объяснена еще и тем, что если, допустим, ион Na+ гидратируется четырьмя молекулами воды, располагающимися в углах тетраэдра, то, очевидно, все четыре молекулы воды, образующие гидратную оболочку Na+, ориентированы его полем таким образом, что их «пустые места» обращены к иону Na+.
Такое расположение молекул воды должно, конечно, нарушать в прилегающих слоях ту взаимную ориентацию, которая характерна для структуры воды. Это должно сказаться и на повышении растворимости в воде иных солей, в частности солей жесткости, уменьшая их осаждение в накипь. Таким «дезорганизующим» действием должен, по видимому, обладать всякий постоянно гидратированный ион независимо от того, какое количество молекул воды он вокруг себя удерживает.
Читайте также: Расчет потребления энергии на судовые опреснительные установки
Переход ионов накипеобразователей из раствора в накипь объясняется тем, что число связанных молекул воды, входящих в гидратную оболочку сольватов, с увеличением концентрации рассола все более увеличивается. В граничном слое пределы насыщения возникают и вновь исчезают при образовании на поверхности нагрева паровых пузырьков. Периодически возникающий локальный дефицит свободных молекул воды приводит к разрушению близрасположенных сольватов. Гидратная оболочка разрушаемых сольватов идет на пополнение поверхностной пленки дистиллята (расходующейся в процессе интенсивного испарения при контактном росте парового пузырька), а освобождающиеся от гидратной оболочки ионы солей соединяются в кристаллы, частично вновь растворяющиеся, а частично образующие накипь и шлам.
Механизм процесса кристаллизации, например CaCO3, можно представить по такой схеме: так как на поверхности теплообмена температура наибольшая, поэтому именно вблизи этой поверхности начинается реакция разложения
При разрушении части сольватов в граничном слое ионы Ca++ и
освобождаются от своих гидратных оболочек и соединяются в кристаллики CaCO3.
В зависимости от места кристаллизации образуется или накипь на поверхности нагрева, или шлам.
Таким образом, интенсивность накипеобразования определяется скоростью передвижения Ca(HCO3)2 к поверхности нагрева и интенсивностью образования кристаллов. Скорость кристаллизации характеризуется скоростью возникновения центров кристаллизации (т. е. зрелых зародышей) и линейной скоростью кристаллизации.
Существует некоторый критический размер зародыша при данной степени пересыщения раствора. Условием устойчивости образовавшегoся кристаллического зародыша служит максимум свободной энергии
где:
- μ1 и μ2 – химические потенциалы исходной и конечной фаз, рассчитанные на 1 моль;
- V2 – молярный объем вновь образующейся фазы;
- σ – удельная поверхностная энергия грани раздела;
- V и S – объем и поверхность вновь образующейся фазы.
Максимум свободной энергии связан с поверхностью критического зародыша S следующим соотношением:
где:
- Sк – критическая поверхность зародыша.
Критический размер сферического зародыша
тогда
Возникновение зародышей ноной фазы следует рассматривать как процесс постоянного дорастания зародышей до критических размеров. Кристаллики (накипеобразователи) должны непрерывно поступать к зародышу. Следовательно, этот процесс характеризуется некоторой вероятностью.
Самопроизвольное возникновение центров кристаллизации в толще пересыщенного рассола граничного слоя возможно благодаря присутствию в жидкости гетерофазных флуктуаций – небольших участков, имеющих такое же расположение молекул, как и в кристалле. При возникновении кристаллика в перенасыщенном рассоле граничного слоя затрачивается энергия на образование поверхности раздела. Если кристаллик меньше некоторого критического размера, эта поверхностная энергия превысит выигрыш в энергии, связанный с переходом в более устойчивое состояние, и энергетически более выгодным будет разрушение кристаллика.
Если размер кристаллика больше критического, то он будет расти. Чем больше перенасыщение, тем меньше работа образования критического зародыша, тем меньше может быть размер критического зародыша и больше вероятность его возникновения. При образовании кристаллика обедненная гидратная оболочка ионов накипеобразователей «выталкивается» на поверхность зародыша. Если работа образования центра кристаллизации на частице нерастворимой примеси меньше, чем работа его самопроизвольного образования, то кристаллизация будет происходить на примесях при меньшем пересыщении рассола, чем в случае самопроизвольной кристаллизации. Существование частиц примесей размером r < rк снижает работу образования зародыша. При r > rк частицы такой примеси могут служить уже готовыми зародышами.
Механизм кристаллизации солей обратен механизму их растворения. При высокой концентрации ионов в рассоле плотность гидратной оболочки молекул воды снижается, уменьшается их «разрывное» действие и при насыщении рассола ионы солей соединяются в кристалл. Попадание вновь образованного кристалла соли (кирпичика накипи) в «кладку» образующейся накипи или в состав частицы шлама предопределяется его расстоянием (а следовательно, силой притяжения) в момент образования до ближайшего из этих двух возможных центров кристаллизации. Таким образом, образуется либо твердая накипь на поверхностях нагрева, либо шлам в граничном слое, выносимый затем в объем всего кипящего рассола.
На поверхностях нагрева сначала отлагаются первичные зародышевые кристаллы размером 0,2 ÷ 0,3 мм, которые затем укрупняются и разрастаются, изменяя свою первоначальную форму. Та или другая структура накипи возникает в зависимости от температуры перегретого граничного слоя, величины тепловой нагрузки поверхности нагрева и концентрации кипящего рассола.
При интенсивном парообразовании и невысокой концентрации кипящего рассола раствор в граничном слое будет быстро беднеть ионами накипеобразователей за счет осаждения их на поверхностях нагрева. В этом случае образование новых центров кристаллизации будет происходить быстрее, чем рост ранее образованных кристаллов. Это и приводит к образованию мелкозернистой накипи.
При повышении концентрации из раствора выделяются новые центры кристаллизации и одновременно с этим часть первоначальных зародышевых кристаллов продолжает расти. В этом случае образуется среднезернистая кристаллическая накипь, включающая иногда пустоты (пузырьки пара) и имеющая повышенное термическое сопротивление.
Плотность и теплопроводность образующейся накипи изменяются. Чем больше кристаллов с нормальной формой и чем более упорядоченную структуру они организуют, тем плотнее и теплопроводнее становится накипь, тем легче она удаляется с поверхности нагрева методом тепловой деформации.
При высоких концентрациях рассола (более 15-20 %) коэффициент теплоотдачи a2, а следовательно, тепловая нагрузка q и производительность испарителя значительно уменьшаются. Одновременно резко возрастает концентрация рассола в граничном слое, и на теплообменной поверхности начинают интенсивно отлагаться кристаллы хлористого натрия.
По достижении в граничном слое концентрации насыщения почти все первичные зародыши кристаллов NaCl продолжают расти, образуя крупнозернистую кристаллическую накипь. В накипь отлагаются и иные соли, но их роль в процессе накипеобразования пренебрежимо мала. Преобладает вторая стадия процесса кристаллизации – бурный рост ранее образованных кристаллов. Поверхности змеевиков испарителя буквально зарастают при этом кристаллами NaCl, образуя сплошной солевой монолит.
Таким образом, на структуру образующейся накипи, а следовательно, на ее плотность и теплопроводность решающее влияние оказывают температура кипения, температурный напор и рабочая концентрация кипящего рассола.
Количество накипи в различных условиях испарения морской воды
Потенциальное количество накипи
Рентгеноструктурный анализ накипи из испарителей морской воды показывает, что в общем случае она образована тремя основными компонентами:
- карбонатом кальция;
- гидроокисью магния;
- сульфатом кальция.
Иногда в очень малых количествах встречается двуокись кремния.
Карбонатная накипь. Преобладающее содержание CaCO3 характерно для вакуумных испарителей, где температура испарения не превышает 75-78 °С. При более высоких температурах эта накипь практически не обнаруживается. Из известных кристаллических модификаций карбоната кальция в испарителях образуется лишь кальцит, решетка которого наиболее проста. Карбонатная накипь характеризуется относительно малой плотностью, рыхлой структурой и низкой прочностью. Она легко растворяется почти всеми кислотами, кроме щавелевой. Все эти качества являются следствием одного свойства карбоната кальция – способности образовывать кристаллы в толще воды.
CaCO3 – продукт диссоциации бикарбонатных ионов при нагревании и упаривании и последующего соединения с ионами кальция по реакциям, приведенным в п. «Исследование накипеобразования в испарителях. Состав и свойства накипи» выше. Чтобы правильно представлять возможность протекания этих реакций, напомним основные сведения о поведении соединений угольной кислоты в воде.
В природных водах лишь около одного процента углекислоты находится в воде недиссоциированных молекул. Большая ее часть диссоциирована. Будучи двухосновной, угольная кислота имеет две следующие ступени диссоциации:
В соответствии с этим в воде одновременно существуют все три формы углекислоты:
- свободная в виде растворенного в воде газа CO2 (и недиссоциированных молекул H2CO3);
полусвязанная в виде ионов
, содержание которой в обычных условиях преобладающее;
связанная в виде карбонатных ионов
.
С соотношением между этими видами углекислоты связана и концентрация водородных ионов (pH). С изменением соотношения, какими бы причинами оно ни вызывалось, изменяется pH. Для температуры 25 °С это соотношение можно видеть на рис. 5.
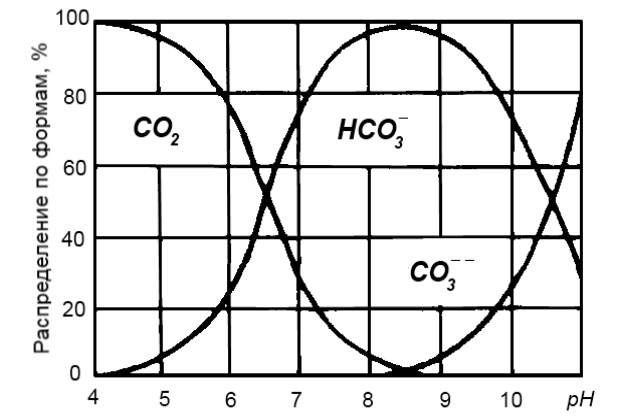
При pH = 4,3 вся угольная кислота представлена только одним соединением – CO2. По мере повышения pH доля CO2 уменьшается с одновременным увеличением доли
, которая достигает максимума (98 %) при pH = 8,3 ÷ 8,4, когда на долю
приходится не более 2 %. С дальнейшим повышением pH свободная углекислота в воде исчезает и появляются карбонатные ионы
при одновременном уменьшении доли бикарбонатных ионов.
Следует, однако, учитывать, что pH является лишь показателем соотношения между углекислотными компонентами, а не определяющим его фактором. Для океанских вод pH зависит главным образом от соотношения концентраций угольной кислоты и ее ионов. В соответствии с законом действия масс
откуда
Таким образом, концентрация водородных ионов обратно пропорциональна
, а pH – прямо пропорциональна концентрации бикарбонатных ионов. По О. А. Алёкину в океанах ионы
образуются преимущественно не за счет диссоциации H2CO3, содержание которой пренебрежимо мало, а в результате диссоциации бикарбонатов Ca(HCO3)2 и Mg(HCO3)2, вымываемых из состава земной коры глубинными океанскими водами и речными стоками.
Бикарбонаты, увеличивая концентрацию
, ведут к уменьшению содержания H+ и соответствующему увеличению pH в сторону слабощелочной реакции, т. е. к появлению ионов OH– в результате гидролиза
В различных районах мирового океана значения pH воды изменяются от 7,9 до 8,3. Верхние значения pH относятся к тропическим районам, где концентрация CO2 снижена ввиду активного поглощения свободной углекислоты морскими растительными организмами.
Суммарное содержание карбонатных и бикарбонатных ионов в поверхностных водах мирового океана более или менее одинаково (в Атлантическом – 145, в Тихом – 147, в Индийском – 145 мг/л). Соотношения между этими ионами вследствие различных атмосферных и гидробиологических условий в разных районах существенно различаются. Определяющим фактором здесь служит содержание двуокиси углерода – как в атмосфере, так и в значительно большей мере в воде. Последнее во многом зависит от деятельности растительных организмов (фитопланктона).
Наиболее активный процесс, ведущий к уменьшению содержания CO2 и
в воде и, следовательно, к повышению содержания
, – фотосинтез, происходящий по схеме
Его интенсивность периодически меняется в течение года и суток в зависимости от освещения, в соответствии с чем меняется и значение pH. Наиболее интенсивно фотосинтез протекает в тропических водах, где и наблюдается усиленное отложение накипи в испарителях. Расход CO2 в поверхностных слоях компенсируется подъемом глубинных вод, где содержание углекислоты значительно выше.
Кроме биохимических процессов, на содержание CO2 в поверхностных слоях воды заметно влияет также и содержание ее в атмосфере. Углекислота характеризуется весьма высокой растворимостью в воде и поэтому при стабильных условиях ее содержание в воде (по закону Генри) прямо пропорционально парциальному давлению pCO2 в атмосфере. По данным Буха при температуре 20 °С и нормальном содержании углекислоты в воздухе (0,033 %) ее растворимость в воде средних широт составляет 680 мл/л.
В северном полярном бассейне
над Тихим океаном
над Индийским
В соответствии с этим при прочих равных условиях различается и содержание CO2 в воде.
В среднем для океанской воды можно приближенно считать, что 96 % ионов угольной кислоты составляют бикарбонатные ионы, в соответствии с чем принимается содержание
В литературе встречаются и иные значения содержания бикарбонатных ионов, часто около 100 мг/л. С учетом указанной зависимости их содержания от скорости выделения или поглощения углекислоты эти различия в данных анализа воды представляются вполне объяснимыми. В океанологических материалах отмечается также, что в открытом океане величина общей щелочности воды колеблется в пределах 2 ÷ 2,5 мг-экв/л, которая на 94-95 % определяется содержанием бикарбонатов и карбонатов и лишь на 5 % – содержанием анионов борной кислоты. Так, в центральной части Атлантики и в арктических водах щелочность колеблется в пределах 2,37 ÷ 2,55 мг-экв/л. В средней части Атлантического океана она составляет 2,07 ÷ 2,42 мг-экв/л.
Нужно, однако, учитывать, что эти цифры справедливы только для океанской воды. В морях, связь которых с океаном ограничена и которые подвержены сильному влиянию материковых стоков, содержание бикарбонатных ионов может быть значительно большим, несмотря на меньшее общее солесодержание.
Для примера можно привести Черное море, где при общем солесодержании около 1 800 мг/л содержание бикарбонатных ионов достигает 200 мг/л. В закрытых бухтах и в устьях южных рек вода еще более насыщена бикарбонатами, содержание которых достигает 300 мг/л. Скорость же диссоциации бикарбонатных ионов определяется главным образом температурой воды и условиями выделения свободной углекислоты из воды. Поэтому и интенсивность образования карбонатной накипи в испарителях также связана главным образом с температурой и условиями выделения свободной углекислоты. Так, в кипящих испарителях углекислота практически полностью выделяется из воды со вторичным паром, и вследствие этого диссоциация бикарбонатов ничем не лимитируется. Поэтому и количество накипи в кипящих испарителях оказывается при прочих равных условиях значительно большим, чем в некипящих (адиабатных). Более того, если в воде создать избыток растворенной углекислоты, то при нагревании ее в закрытых подогревателях удается избежать отложений карбонатной накипи даже при температурах выше 70-80 °С Одно из практических приложений этого свойства – использование дымовых газов для насыщения воды углекислотой в системах оборотного охлаждения на электростанциях. Применительно к испарителям морской воды предложено видоизменение этого метода. Суть его в том, что в питательную воду перед конденсатором последней ступени адиабатного испарителя компрессором нагнетают углекислоту, а по выходе воды из подогревателя ее улавливают и снова подают в компрессор. Таким образом, во всех конденсаторах и подогревателях проходит вода, насыщенная углекислотой и не образующая накипи.x.
В стационарных опреснительных установках с многоступенчатыми адиабатными испарителями используется иной способ снижения накипеобразования, основанный на предварительном осаждении карбоната кальция в отстойниках деаэратора, где он образуется по вышеприведенным реакциям вследствие энергичного удаления CO2 при деаэрации.
Одновременно благодаря удалению CO2 из воды уменьшается ее агрессивность по отношению к металлам и становится возможным применять в качестве конструкционного материала углеродистую сталь. Однако, на судах такой метод не нашел применения ввиду больших габаритов отстойника.
Для оценки интенсивности образования карбонатной накипи в кипящих испарителях при заданных температуре и концентрации рассола может быть использована диаграмма Ланжелье (рис. 6).
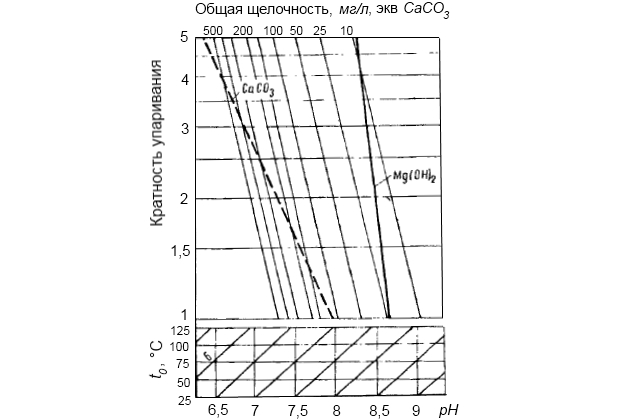
На этой диаграмме показаны линии растворимости CaCO3 в морской воде в зависимости от исходной величины ее водородного показателя и кратности упаривания. Диаграмма построена для стандартной морской воды с исходной щелочностью 2,4 мг·экв/л, чему соответствует содержание бикарбонатных ионов 146 мг/л, а при условии полной их диссоциации – содержание CaCO3 119,8 мг/л.
Наклонная пунктирная линия отражает теоретическое количество CaCO3 в paccoлe при различной кратности упаривания в предположении, что в процессе упаривания содержание CaCO3 не изменяется.
Влияние температуры испарения на растворимость учитывается наклоном линий pH на вспомогательной сетке вдоль оси абсцисс. Наклон выбран на основании экспериментально установленной разницы между pH насыщения при температурах 100 и 25 °С, которая оказалась равной 0,4.
Для воды с заданным исходным значением pH диаграмма позволяет определить степень упаривания, допустимую без риска образования накипи при той или иной температуре испарения. Так, если в распоряжении имеется морская вода с исходным значением pH = 7, то при температуре на поверхности нагрева (и воды в непосредственной близости) 65 °С накипь выпадать не будет, если кратность упаривания не превышает 1,5.
Рекомендуется к прочтению: Теория работы и типы опреснительных установок на судне
К сожалению, ни в одной точке океана столь низкие значения pH не наблюдаются, так что для обеспечения безнакипной работы испарителя при этих условиях пришлось бы прибегнуть к искусственному снижению pH, например путем добавки кислоты, как это практикуется в береговых опреснителях. При значениях pH, которые встречаются наиболее часто (7,9 ÷ 8,2), морская вода оказывается насыщенной уже при температуре 25-30 °С.
Диаграмма позволяет определить и количество избыточного CaCO3, если при данной температуре и кратности упаривания предел насыщения превзойден. Так, для воды с исходным значением pH = 7,8 при температуре 70 °С и кратности упаривания 2 по диаграмме находим, что растворимость CaCO3 или равновесное его содержание составляет всего 80 мг/л. Внесенное же в испаритель с водой потенциальное количество CaCO3, как видно в точке пересечения линии насыщения и линии двукратного упаривания, составляет 240 мг/л. Следовательно, 210 мг карбоната кальция на каждый литр рассола или 87,5 % внесенного количества CaCO3 должны выпасть в виде накипи и шлама.
Если кратность упаривания равна 1,5, то количество избыточного CaCO3 несколько уменьшается. Равновесное содержание CaCO3 в этом случае составляет 36 мг/л, внесенное в испаритель – 180 мг/л рассола. Тогда избыток составит 144 мг/л. В пересчете на 1 л дистиллята получим потенциальное (максимально возможное) количество накипи в первом случае 216 мг, во втором 288 мг. Такой результат на первый взгляд представляется парадоксальным и во всяком случае противоречащим общепринятой практике эксплуатации вакуумных испарителей с коэффициентом подачи питательной воды 3-4 (см. «Примеры расчета опреснительных установок на суднеРасчет одноступенчатого испарителя кипящего типа с паровым обогревом»).
Приведенные цифры являются чисто теоретическими и возможны лишь при такой продолжительности пребывания рассола в испарителе, которая была бы достаточной для полного распада бикарбонатов и осаждения избыточных накипеобразователей.
В действительности рассол находится в испарителе не более 15-30 мин, что совершенно недостаточно для полной кристаллизации. Поэтому не все избыточные накипеобразователи выпадают из раствора и рассол, удаляемый из испарителя, остается пересыщенным (в нем находится до 1/3 избыточных солей жесткости в виде ионов, не успевших образовать кристаллы). Значительная часть кристаллов, возникших в толще воды (до 1/3 от избытка CaCO3), также не успевает осесть на поверхности нагрева и удаляется с рассолом во взвешенном состоянии. Диссоциация бикарбонатных ионов, занимающая определенное время, также оказывается неполной. По данным Пивера в испарителях успевает диссоциировать не более 63 % ионов HCO3. Остальные не диссоциируют при всех условиях. Лишь 30-40 % избытка CaCO3 оседает в виде накипи на всех поверхностях, преимущественно теплопередающих.
По данным Хильера потенциальные накипеобразователи (карбонатная щелочность) питательной воды в опытном испарителе с температурой 71 °С распределяются, как показано в табл. 3.
| Таблица 3. Распределение щелочности морской воды в испарителе | |||||
|---|---|---|---|---|---|
| Форма существования карбонатов | Щелочность, эквивалентная CaCO3, мг на 1 л питательной воды | ||||
| кратность упаривания | |||||
| 1,5 | 2,0 | 2,5 | 3,0 | 3,3 | |
| CaCO3 в суспензии | – | – | – | 6 | 11 |
| CaCO3 в растворе | 52 | 46 | 42 | 36 | 32 |
| Mg(OH)2 в суспензии | 24 | 24 | 22 | 21 | 20 |
| CaCO3 (накипь на змеевиках и корпусе) | 39 | 45 | 51 | 52 | 52 |
| Сумма, эквивалентная CaCO3 | 115 | 115 | 115 | 115 | 115 |
О существовании недиссоциированных бикарбонатных ионов Хильер не упоминает, но отмечает присутствие в рассоле значительного количества карбонатных ионов, не вступивших в соединение с ионами кальция, несмотря на большой избыток последних.
Что касается характера изменения веса накипи с увеличением кратности упаривания, то отмеченная закономерность наглядно подтверждается натурными опытами Хильера, результаты которых приведены на рис. 7.
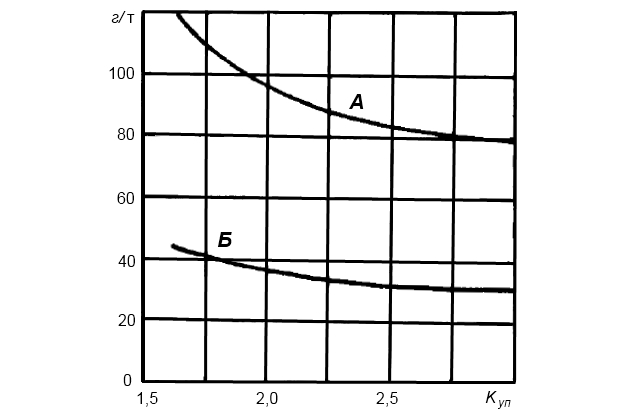
А – при t2 = 71 °С ∆t = 32,8 град (накипь CaCO3); Б – при t2 = 93,5 °С ∆t = 22,2 град [накипь Mg(HO)2]
Верхняя кривая на этом рисунке как раз соответствует рассмотренным выше условиям. Вес накипи на змеевиках составляет ориентировочно 40 % от потенциального веса накипи и также уменьшается по мере увеличения кратности упаривания. То обстоятельство, что в судовых испарителях при этих условиях кратность упаривания большинством фирм рекомендуется 1,5, а не 2, несмотря на большой вес образующейся накипи, объясняется многими соображениями, подробно рассмотренными в «Конструкции судовых опреснителей и характеристики опреснительных установокВакуумные испарители паротурбинных судов».
Здесь отметим, что для стабильности теплопередачи в испарителе и сохранения его производительности имеет значение не вес накипи, а приращение теплового сопротивления, которое должно быть возможно малым
где:
- δн – толщина слоя накипи на теплопередающих поверхностях;
- λн – коэффициент теплопроводности.
Пренебрегая изменением удельного веса накипи, полученной при различных концентрациях, можем считать δ пропорциональной весу и оценивать по данным Хильера.
Теплопроводность накипи, как показано в п. «Исследование накипеобразования в испарителях. Состав и свойства накипи», весьма заметно изменяется с изменением солесодержания рассола, в котором она образовалась, в частности, при B = 7 % (кратность упаривания 2) теплопроводность оказывается наименьшей. Принимая, что при этом за время τ толщина слоя накипи достигает δн = 1 мм и λн = 0,5 ккал/(м·ч·град), получим для двукратного упаривания приращение теплового сопротивления δн/λн за период работы τ 0,002 (м2 · ч · град)/ккал. За то же время при полуторакратном упаривании
мм, а
ккал/(м·ч·град), так что тепловое сопротивление увеличивается на
Таким образом, в последнем случае приращение теплового сопротивления оказывается на 10 % меньше, несмотря на более интенсивное образование накипи. Это обстоятельство и следует считать решающим при назначении кратности упаривания и коэффициента подачи питательной волы.
Гидроокись магния Mg(OH)2 – основной компонент накипи в испарителях, работающих при давлении, близком к атмосферному, если кратность упаривания не превышает 2 ÷ 2,5. Магнезиальная накипь отличается от карбонатной большей плотностью и теплопроводностью. Для магнезиальной накипи при B = 7 % λ на 10-15 % больше, чем для карбонатной (см. рис. 2). Кристаллическая гидроокись магния известна под названием бруцит. Существует и гидратная аморфная гидроокись, отлагающаяся при высокой форсировке. Со временем она также превращается в бруцит. Гидроокись магния значительно хуже растворяется кислотами, чем карбонатная накипь. Меньше и ее растворимость в воде. На диаграмме Ланжелье (рис. 6) предел насыщения для Mg(OH)2 показан жирной наклонной линией.
Образование гидроокиси магния в испарителях обусловлено гидролизом карбонатных ионов, который интенсивно протекает при температурах более 75 °С, и весьма малой растворимостью гидроокиси магния (вчетверо меньшей, чем для карбоната кальция). Произведение растворимости Mg(OH)2 составляет лишь 6·10-10 при 18 °С, что на порядок ниже, чем для CaCO3. Поскольку и здесь исходным является карбонатный ион, то интенсивность отложения магнезиальной накипи в зависимости от биохимических и атмосферных процессов и от условий выделения CO2 из воды оказывается такой же, как и для карбонатной накипи кальция. Хильер на основании своих натурных испытаний опреснителей отмечает, что гидроокись магния образуется в небольших количествах и при температурах меньше 75 °С. Однако она при этом остается в суспензии. И лишь с началом интенсивного распада
переходит в накипь при соответственном уменьшении доли CaCO3.
Другой механизм образования гидроокиси дается Ридом. Он считает, что гидроокись магния образуется при температурах в пограничном слое более 110 °С в результате гидролиза MgCl2, содержание которого в воде весьма велико, по реакции
В ионной форме
Образующиеся при этом ионы водорода отчасти уменьшают щелочность раствора, способствуя тем самым увеличению растворимости CaCO3. Иначе это можно представить как результат взаимодействия HCl с ранее образовавшейся карбонатной накипью
где:
- CaCl2 – хорошо растворимая соль, как все хлориды.
В ионной форме
Этим и объясняется резкое уменьшение доли CaCO3 в составе накипи при повышенных температурах испарения. При низких температурах гидролиз протекает крайне медленно. Таким образом, очевидно, что чем выше температура в пограничном слое, тем раньше начинается отложение Mg(OH)2 на трубках. Поэтому в испарителях с большей тепловой напряженностью, где температура трубок выше, гидроокись магния образуется при меньшей температуре испарения, чем в слабонапряженных испарителях.
Сравнительно малое значение pH рассола (8 ÷ 8,6), соответствующее содержанию гидроксила в нем не более 0,017 ÷ 0,1 мг/л, указывает на то, что гидроокись магния практически нерастворима в воде, а сколько-нибудь значительного пересыщения гидроокисью раствор не выдерживает.
Важно, однако, отметить, что потенциальное количество магнезиальной накипи меньше, чем карбонатной, несмотря на меньшую растворимость гидроокиси магния. Объясняется это тем, что при гидролизе карбонатного иона теряется молекула углекислоты. В результате один карбонатный ион вместо молекулы Здесь и дaлee термин «молекула» применительно к кристаллическим накипеобразователям используется не в строгом смысле этого слова, а лишь для удобства изложения и использования стехиометрических соотношений.x CaCO3 с молекулярным весом 100 в конечном счете приводит к образованию молекулы Mg(OH)2 с молекулярным весом 58.
Таким образом, и вес магнезиальной накипи, образующейся в этом случае вместо карбонатной, должен составлять при прочих равных условиях лишь 58 % от веса карбонатной. Разумеется, однако, что одинаковых условий образования этих двух видов накипи быть не может. Тем не менее, если сравнить потенциальные веса карбонатной накипи при температуре испарения, например, 70 °С и магнезиальной накипи при температуре 80 °С, то последний все же окажется меньше. Для кратности упаривания 2 по диаграмме Ланжелье растворимость Mg(OH)2 составляет 17 мг/л. Однако следует учитывать, что на диаграмме указаны эквивалентные веса для CaCO3. Поэтому, пользуясь диаграммой Ланжелье для определения содержания гидроокиси магния, нужно все отсчеты умножить на коэффициент 0,58, так что истинная ее растворимость составит 10 мг/л. Внесенное с питательной водой количество накипеобразователей в пересчете на Mg(OH)2 составит
Отсюда потенциальное количество магнезиальной накипи
Потенциальное количество карбонатной накипи при 70 °С составляет 210 мг/л. Этот пример в какой-то степени объясняет существование минимума при 82-85 °С на линии количества накипи в зависимости от температуры в серии лабораторных опытов Хильера.
Натурные испытания, результаты которых можно видеть на рис. 8, также обнаруживают локальный минимум при этих температурах и убедительно свидетельствуют об уменьшении количества накипи по мере перехода от CaCO3 к Mg(OH)2 с повышением температуры до 82-85 °С.
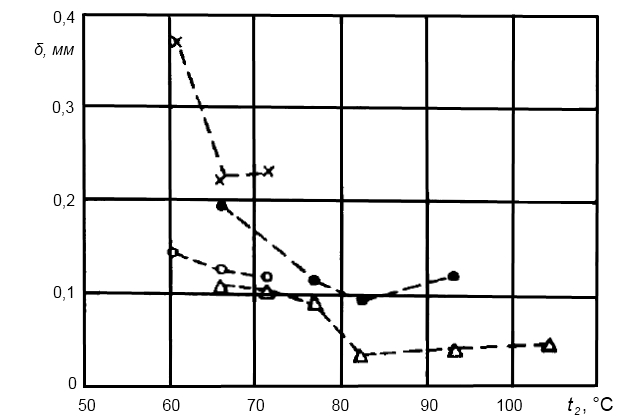
× – × – Kуп = 1,5, ∆t = 44,5 град; ● – ● – Kуп = 2, ∆t = 44,5 град; ○ – ○ – Kуп = 1,5, ∆t = 12,2 град; △ – △ – Kуп = 2, ∆t = 12,2 град
Если бы на том же рисунке был представлен вес, а не толщина накипи, то очевидно, что наклон кривых, особенно при пониженных температурах, был бы значительно меньшим.
Сульфатная накипь составляет основную помеху в работе испарителей при температуре выше 100-120 °C. Ее осаждение – прямое следствие понижения растворимости сульфата кальция с увеличением температуры. Сульфат кальция зачастую отлагается в испарителях с давлением вторичного пара, близким к атмосферному, и свидетельствует о том, что эти испарители эксплуатировались с кратностью упаривания более 3 ÷ 3,5. Чем выше температура испарения или напряженность поверхности нагрева, тем меньше кратность упаривания, при которой начинается отложение сульфатной накипи. Сульфатная накипь наиболее труднорастворима, а ее предотвращение наиболее сложно. Если отложения карбонатной и магнезиальной накипи удается предотвратить более или менее доступными средствами, то для сульфатной накипи существующие методы требуют усложнения установок и удорожания их эксплуатации.
Известны три модификации сульфата:
- ангидрит CaSO4;
- полугидрат CaSO4 · 1/2H2O;
- дигидрат (или гипс) CaSO4 · 2H2O.
Две последние модификации при нагревании постепенно теряют кристаллическую воду и превращаются в ангидрит. Известны еще три кристаллические формы, но в контакте с растворами они существовать не могут. Наименее растворимая из этих модификаций – ангидрит, но скорость ее кристаллизации столь мала, что в испарителях она встречается редко. Значительно лучше растворяется гипс, причем растворимость его практически не зависит от температуры. В испарителях, где температура стенки не превышает 85 °С, гипс встречается лишь при кратностях упаривания более 4,25. В испарителях сульфатная накипь наиболее часто представлена полугидратом, который появляется при температурах более 85 °С.
Кратность упаривания, при которой наступает предел растворимости каждого из этих сульфатов, показана в зависимости от температуры по данным Стэндифорда и Сайнека на рис. 9.
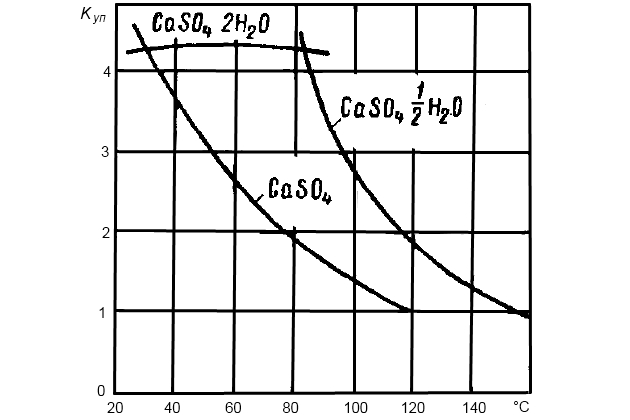
Поддержание концентраций ниже предела растворимости для CaSO4 · 1/2H2O, указанного на этом графике, является пока единственной гарантией отсутствия сульфатной накипи на греющих поверхностях.
Пользуясь диаграммами растворимости CaCO3, Mg(OH)2 и CaSO4 · 1/2H2O, можно определить потенциальное количество накипи при различных температурах испарения в широком диапазоне кратности упаривания, как это представлено по результатам расчетов на рис. 10.
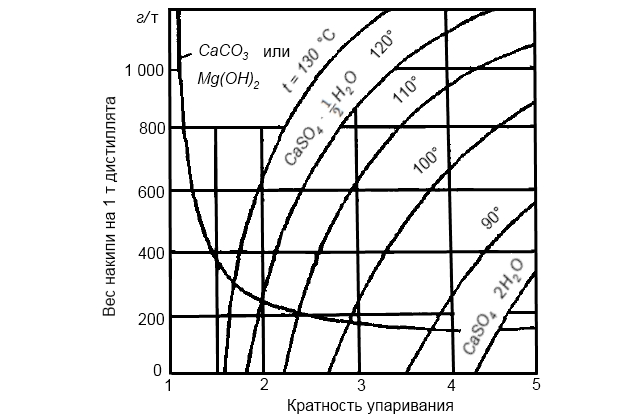
По этому графику можно судить о кратности упаривания для испарителей с различной температурой, когда достигается минимум потенциального количества накипи. Так, для температуры 100 °С оптимальной можно признать кратность 2,5. При меньшей кратности вес накипи увеличивается вследствие большого поступления карбонатов, а при большей – вследствие осаждения сульфата кальция. Чем ниже температура испарения, тем выше оптимальная кратность упаривания. Однако оценивая эту величину, нужно учитывать ранее сказанное о теплопроводности накипи, а также последствия вероятного повышения кратности упаривания при случайных нарушениях питания испарителя и циркуляции в нем. Как видно из рис. 10, риск усиления накипеобразования значительно меньше при уменьшении упаривания, чем при его увеличении. Поэтому кратность упаривания более 2 не допускается.
Реальное количество накипи в зависимости от основных конструктивных и эксплуатационных факторов
Из вышеизложенного ясно, сколь велико многообразие факторов, определяющих интенсивность накипеобразования, т. е. количество накипи, образующейся на поверхности нагрева за определенный промежуток времени работы испарителя. В числе этих факторов особого внимания заслуживают те, которые можно назначить по выбору в процессе проектирования или в ходе эксплуатации испарителя.
К ним относятся:
- температура испарения и способ нагрева (с кипением в объеме или без кипения);
- интенсивность теплового потока;
- концентрация рассола;
- паросодержание воды вблизи поверхностей нагрева и время контакта воды с поверхностью нагрева;
- скорость движения воды вблизи поверхностей нагрева;
- условия циркуляции и существование застойных зон в водяном объеме испарителя;
- степень погружения батареи в испаряемую воду.
Многие из этих факторов взаимно обусловлены, и проследить роль каждого из них порознь затруднительно.
В число перечисленных факторов намеренно не включены те, которые используются в качестве основы для борьбы с накипью:
- противонакипные присадки;
- затравочные кристаллы;
- упругие нагревательные элементы и другие.
Рассмотрим в первую очередь кипящие испарители, где проблема накипеобразования наиболее сложна.
Основными факторами бесспорно признаются температура испаряемой воды, а также температура теплопередающей поверхности. До работ Хильера и ряда других исследователей температуру испаряемой воды считали единственным заслуживающим внимания фактором, а характер ее влияния упрощенно принимали совершенно однозначным: чем ниже температура испарения, тем меньше интенсивность накипеобразования, и наоборот.
С учетом ранее изложенного влияние температуры испарения в широком интервале в общем виде может быть представлено ломаной линией с тремя характерными участками:
I – зона образования CaCO3 – вес накипи увеличивается по мере роста температуры испарения до 70-75 °С;
II – зона перехода от CaCO3 к Mg(OH)2 – вес накипи уменьшается вследствие образования Mg(OH2) и потери CO2;
III – зона образования Mg(OH)2 и CaSO4 · 1/2H2O – вес накипи увеличивается в соответствии с увеличением степени пересыщения и ростом интенсивности теплового движения. Кроме того, по мере увеличения температуры в составе накипи появляется все возрастающее количество сульфатов кальция.
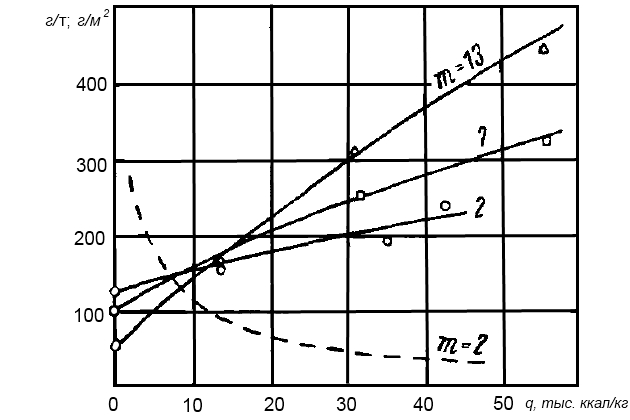
Особо следует оговорить, что и в начальной части зоны I в области температур испарения около 35 °С количество накипи отнюдь не равно нулю, хотя степень пересыщения здесь весьма мала (рис. 11).
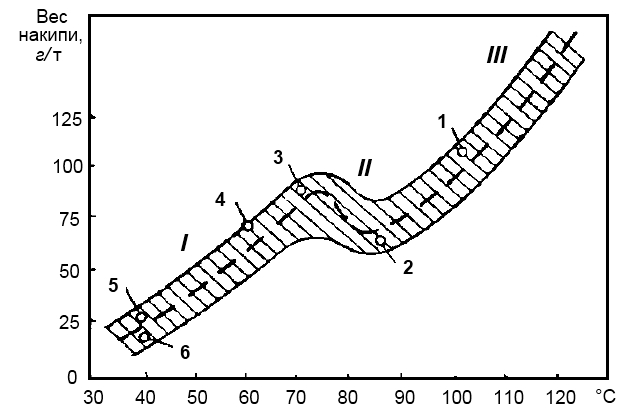
— — — — средние величины.
I – зона образования карбоната кальция; II – переходная зона; III – зона образования гидроокиси магния. Вес накипи на 1 т дистиллята (по данным эксплуатации испарителей).
1 – ИВС-3; 2 – «Максим»; 3 – натурные испытания Хильера; 4 – ИКВ-З9; 5 – «Эврика»; 6 – «Атлас» АФГУ-7
Объясняется это тем, что сравнивать интенсивность образования накипи можно лишь при одинаковых тепловых потоках, и если принять характеризующую поток разность температур греющего и вторичного пара равной 20 °С (как в большинстве судовых испарителей), то температура пристенного слоя рассола будет примерно на 10 град больше температуры рассола, и поэтому степень его пересыщения оказывается значительной.
Кроме того, для сохранения тепловых потоков при низких температурах рассола необходимо ввиду повышенной его вязкости иметь более высокий температурный напор (во всяком случае между стенкой и основной массой рассола), в связи с чем количество накипи на 1 т дистиллята в этих испарителях достигает 20 г при удельном паросъеме 100-120 кГ/м2. Лишь в утилизационных опреснителях с удельным паросъемом 40-50 кГ/(м2 · ч) вес накипи не превышает 20 г на 1 т дистиллята, но при этом и температура греющей поверхности оказывается не более 45 °С.
Вообще при сравнении количества накипи в различных условиях за определяющий фактор более правильно принимать температуру стенки, а не рассола.
Исходя из диаграммы Ланжелье, не приходится ожидать существенного уменьшения количества накипи по мере снижения температуры. Так, для воды, имеющей pH = 7,8, потенциальное количество накипи в случае двукратного упаривания при температуре 100 °С составляет в соответствии с диаграммой 222 мг/л (в пересчете на CaCO3). При понижении температуры до 50 °С потенциальное количество CaCO3 уменьшается лишь до 190 мг/л, т. е. всего на 15 %.
В действительности в вакуумных испарителях вес накипи, образующейся на 1 т дистиллята, в несколько раз меньше, чем в испарителях избыточного давления. Объясняется это многими факторами, рассмотренными подробнее ниже. Здесь же отметим еще одно обстоятельство, прямо связанное с температурой испарения: скорость распада бикарбонатов. Будучи соизмерима со временем задержки рассола в испарителе, она оказывает весьма заметное влияние на действительное количество выпадающей накипи.
Судить о скорости распада бикарбонатов можно по рис. 12, где представлены данные лабораторных измерений.
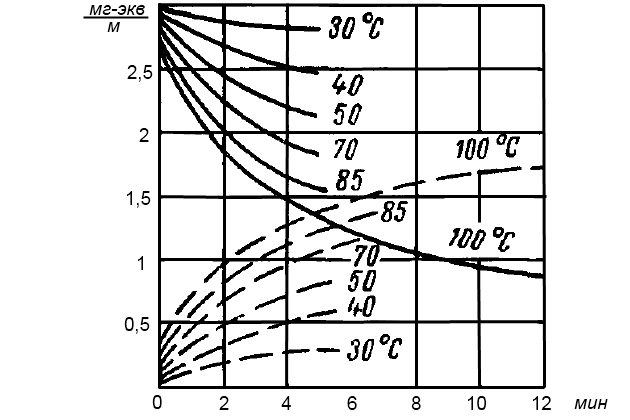
——– бикарбонатная щелочность; — — — — карбонатная
Как видно из графика, распад бикарбонатов и соответственно рост концентрации карбонатов при кипячении морской воды происходит сравнительно медленно, так что имеется возможность воздействовать на накипеобразование, уменьшая время задержки рассола в испарителе любыми средствами (уменьшением водосодержания, повышением тепловой напряженности и т. д.). Важно, однако, отметить, что за время задержки рассола (~10-15 мин) при температуре около 100 °С распадается около 2/3 бикарбонатов, т. е. большая часть потенциальной накипи может оказаться на теплопередающих поверхностях. Но по мере понижения температуры скорость распада бикарбонатов заметно уменьшается и, таким образом, меньшей оказывается и степень пересыщения рассола. По-видимому, этим и объясняется отмеченное в практике эксплуатации вакуумных испарителей более существенное уменьшение количества накипи по сравнению с атмосферным, чем можно ожидать исходя из диаграммы растворимости.
Приведенные данные могут быть использованы и для приближенного расчета количества карбонатной накипи, образующейся в вакуумных испарителях. Для этого к потенциальному количеству накипи, определяемому из диаграммы Ланжелье, следует ввести поправку на степень распада бикарбонатов
где:
- – коэффициент, учитывающий время задержки рассола (при τ > 15 мин kτ = 1);
- – поправка на температуру рассола.
При этом учитывается, что степень распада бикарбонатов прямо пропорциональна разности между температурой кипения и комнатной температурой, при которой содержание карбонатов близко к нулю.
Напряженность теплового потока q – второй по значению фактор, характер влияния которого аналогичен влиянию температуры, так как тепловым потоком определяются и температуры стенки и прилегающего к ней слоя рассола. То, что с увеличением теплового потока количество накипи на теплопередающих поверхностях возрастает, доказательств не требует.
Гораздо сложнее ответить на вопрос: увеличивается ли при этом количество накипи, отнесенное к количеству передающего тепла или к количеству вторичного пара, приходящегося на единицу площади теплопередающей поверхности (относительное количество накипи). Существующие на этот счет опытные данные противоречивы и не позволяют пока дать количественную оценку для наиболее типичных случаев. Для качественной оценки картина накипеобразования под влиянием различных потоков представляется в следующем виде.
В общем случае пузырькового кипения наблюдается два существенно различных процесса отложения накипи на теплопередающих поверхностях:
- Отложение колец или кружков накипи в основании паровых пузырьков на границе тройного раздела фаз в условиях повышенной местной концентрации и интенсивных местных тепловых потоков (см. п. «Исследование накипеобразования в испарителях. Состав и свойства накипи» выше). При этом образуется плотная накипь.
- Кристаллизация из пересыщенного раствора, омывающего всю остальную теплопередающую поверхность, и прикипание выпавших в толще рассола частиц накипи и шлама. При этом образуется более рыхлая накипь с меньшей теплопроводностью, чем в первом случае.
Для оценки роли второго процесса напомним, что растущими паровыми пузырьками занята не вся поверхность нагрева, особенно при умеренных тепловых нагрузках. Поэтому сводить весь механизм накипеобразования в испарителях к первому процессу было бы глубоко ошибочно. Более того, даже непосредственно под паровым пузырьком после его отрыва в так называемый период ожидания Период ожидания, или время между отрывом очередного пузырька и зарождением нового, ориентировочно в три раза превышает период роста пузырька.x может происходить процесс кристаллизации. Его интенсивность, однако, пренебрежимо мала ввиду энергичной турбулизации раствора, обусловленной ростом и отрывом пузырьков. Лишь при тепловых потоках, близких к критическим, образование накипи за счет возникновения колец или кружков становится доминирующим процессом.
Количество накипи, образующееся при первом процессе, можно считать прямо пропорциональным количеству генерированных паровых пузырьков, т. е. в конечном счете – прямо пропорциональным количеству переданного тепла. При втором процессе количество накипи от тепловой нагрузки зависит очень слабо: лишь постольку, поскольку при этом растет пересыщение пристенного слоя вследствие повышения температуры стенки.
Последняя с увеличением теплового потока изменяется сравнительно мало, о чем можно судить по формуле Г. Н. Кружилина. Поэтому в случае малых тепловых потоков, когда число действующих центров парообразования невелико и на большей части поверхности идет кристаллизация и оседание взвешенных частиц, относительное количество накипи значительно и при тепловых потоках, близких к нулю, становится равным потенциальному.
Наоборот, по мере увеличения q относительное количество накипи уменьшается и достигает минимума вблизи qкр, когда парообразующая поверхность занята паровыми пузырьками, так что влияние второго процесса становится пренебрежимым.
При двукратном упаривании и атмосферном давлении этот минимум можно ориентировочно оценить по различным косвенным данным (15-20 г на 1 т дистиллята, т. е. не более 10 % от потенциального количества накипи). С этой трактовкой хорошо согласуются результаты лабораторных 100-часовых испытаний модели испарителя, где накипь откладывалась в условиях свободной конвекции на змеевиках с электрическим обогревом мощностью до 2 квт. Данные этих испытаний при различных значениях коэффициента продувания приведены на рис. 13.
Сплошными линиями показан вес накипи за 100 ч, отнесенный к 1 м2 поверхности змеевиков, пунктирной – отнесенный к 1 т дистиллята. При q = 0 указан вес накипи, отложившейся на необогреваемом змеевике, расположенном между двумя обогреваемыми.
Та же тенденция подтверждается опытом эксплуатации ряда испарителей избыточного давления на судах промыслового флота, характеристики которых приведены в табл. 4.
| Таблица 4. Характеристики испарителей избыточного давления на судах промыслового флота | |||
|---|---|---|---|
| Марка испарителя | WY-6 | ИВС-3 | ИЕР-7 |
| Тип судна | «Пионерск» | ВМРТ | БМРТ |
| Производительность, т/сутки | 45-50 | 10-11 | 7-8 |
| Поверхность нагрева, м2 | 8,7 | 2,72 | 4,2 |
| Тепловой поток, ккал/(м2 · ч) | 165 ÷ 103 | 120 ÷ 103 | 48·103 |
| Удельный паросъем, кг/(м2 · ч) | 220 | 155 | 68 |
| Слой накипи на 100 ч, мм | 1 ÷ 1,1 | 1 ÷ 1,2 | 0,45 ÷ 0,5 |
| Вес накипи на 1 т дистиллята, г | 70-80 | 120-130 | 140-150 |
| Период работы между чистками, ч | 180-140 | 250-300 | 500-600 |
Как видно из таблицы, в слабонапряженных испарителях относительный вес накипи в полтора раза больше, чем в высоконапряженных. Тем не менее при ручной очистке от накипи эксплуатация слабонапряженных испарителей более удобна благодаря большому периоду работы между чистками.
Приведенные данные достаточно наглядно иллюстрируют влияние напряженности поверхности нагрева. Поэтому при сравнении накипеобразования в различных условиях этот фактор следует учитывать как один из важнейших. Влиянием роста q в значительной мере объясняется то уменьшение веса накипи, которое отмечено при увеличении температуры испарения в опытах Хильера. Особенно большое значение это имеет в связи с разработкой новых конструкций испарителей с повышенной интенсивностью теплопередачи, в частности тонкопленочных.
В качестве дополнительного фактора, способствующего дальнейшему уменьшению относительного веса накипи по мере увеличения тепловой напряженности, можно отметить и более интенсивное самоочищение греющих поверхностей при тепловых и механических деформациях, величина которых при больших тепловых потоках неизбежно оказывается повышенной (например, при использовании пара высокого давления). Вместе с тем увеличение тепловой напряженности за счет повышения давления греющего пара не может быть оправдано достигаемым снижением относительного веса накипи, поскольку при этом резко ухудшаются экономические характеристики испарителя (см. «Расчет потребления энергии на судовые опреснительные установкиОпределение расхода топлива на опреснительную установку»).
Суждения о роли концентрации рассола – одного из важнейших определяющих факторов – весьма противоречивы. Одни считают, что концентрация рассола должна быть по возможности малой, так как чем меньше концентрация, тем менее благоприятны условия для выпадения накипи, особенно сульфатов. Такова точка зрения Ф. Л. Анатолиева и других авторов, основывающаяся на диаграмме растворимости CaSO4.
Выше указывалось, что из всех сульфатов кальция ангидрит – наиболее медленно кристаллизуемая форма и что в испарителях она практически никогда не образуется в процессе испарения. То, что при кристаллографическом анализе накипи ангидрит иногда обнаруживают, объясняется постепенным его, образованием из полугидрата, который и выпадает в процессе испарения морской воды. Наиболее же распространенный в составе накипи полугидрат сульфата кальция откладывается лишь при тройной концентрации.
Другие экспериментальные данные (рис. 13), подтверждают, что снижение концентрации рассола за счет подачи большого избытка питательной воды только увеличивает количество накипи вследствие поступления в испаритель с морской водой накипеобразователей.
В соответствии с графиком потенциального количества накипи оптимальная концентрация рассола должна соответствовать кратности упаривания около 2,5. И лишь опасность возникновения более высоких местных концентраций вынуждает ориентироваться в практике эксплуатации и проектирования на более умеренную кратность упаривания (от 2 до 1,5). Первая практикуется в испарителях избыточного давления, где нежелательны большие тепловые потери с продуваемым рассолом. Вторая – в вакуумных испарителях, где пониженная концентрация солей упрощает проблему сепарации вторичного пара, значение которой увеличивается по мере углубления вакуума.
Кроме того, как уже говорилось, при концентрации солей менее 5 % теплопроводность накипи больше, чем при концентрации 7 %, соответствующей двукратному упариванию. Потери тепла с рассолом в вакуумных испарителях значительно меньше, так что некоторое увеличение количества продуваемого рассола не сказывается заметно на экономичности.
При повышенных значениях коэффициентов подачи воды достигается более благоприятное соотношение между количеством фактически отложившейся и потенциальной накипи. Так, если при m = 2 в опытах Хильера откладывалось на трубках около 40-44 % от потенциального количества накипи, то при m = 3 эта доля снижалась до 36-38 %, хотя абсолютное количество накипи в последнем случае было больше. Иными словами, фактическое количество накипи с ростом коэффициента подачи увеличивается в значительно меньшей степени, чем потенциальное, причем с увеличением вакуума эта разница возрастает. Объясняется это большей скоростью движения рассола, затрудняющей кристаллизацию, меньшим временем распада бикарбонатных ионов в испарителе и меньшей скоростью распада бикарбонатов при пониженных температурах.
Не случайно поэтому в развитии современных вакуумных опреснителей отмечается тенденция к уменьшению водосодержания и соответствующему сокращению времени прохождения опреснителя рассолом (времени задержки). Особенно заметное уменьшение времени задержки (до 1 мин) достигается в вертикально-трубных испарителях. Сокращению времени задержки способствуют также увеличение коэффициента подачи и скорости воды в трубках, а также отказ от циркуляции в последних конструкциях вертикально-трубных испарителей.
Проведенные лабораторные опыты показали, что распад большей части бикарбонатов (80-90 %) происходит в первые 15-20 мин, причем количество распавшихся бикарбонатов можно считать линейной функцией времени. Между тем для большинства наиболее распространенных конструкций горизонтальных прямотрубных и змеевиковых батарей время задержки составляет 10-15 мин при коэффициенте подачи m = 2 – 3.
С увеличением m до 4-5 обратно пропорционально уменьшается время задержки и, следовательно, уменьшается возможное выпадение накипи из каждой тонны питательной воды. В результате совместного действия этих двух факторов количество накипи, выпадающей в таких испарителях, не изменяется, но в то же время улучшаются теплоотдача и условия сепарации вторичного пара.
В заключение заметим, что с точки зрения образования накипи концентрация солей в морской воде имеет значение лишь как показатель степени упаривания. Во многих морях и прибрежных водах концентрация солей ниже, чем в океане, но количество накипи от этого в испарителе не меньше, а зачастую больше, чем при работе в океане, вследствие большого содержания бикарбонатов.
Паросодержание смеси испаряемой воды и пара в испарителе оказывает заметное влияние на условия образования накипи главным образом в водотрубных испарителях, особенно при большой напряженности поверхности нагрева или глубоком вакууме. В частности, такая проблема возникает в утилизационных глубоковакуумных вертикально-трубных опреснителях «Атлас» и в сходных с ними конструкциях российских опреснителей серии Д, а также в опреснителях ФЕБ Хемнанлагенбау (ГДР), устанавливаемых на новых промысловых судах.
Будет интересно: Конденсатно-питательные и паровые системы на судне
В трубках этих опреснителей ввиду большого количества паровых пузырьков, сливающихся в верхней их части в сплошные «снаряды», возникает так называемый снарядно-стержневой режим течения смеси, когда между «снарядом» пара и стенкой трубки сохраняется лишь тонкая пленка воды, которая при большой напряженности может испариться досуха. Во всяком случае степень упаривания здесь значительно более высокая, чем в тех конструкциях, где рассол находится снаружи трубок. Во избежание этого греющие трубки выполняют короткими (высотой не более 600 мм) и их диаметр (внутренний) принимается не менее 16 мм.
Радикальное средство предотвращения такого режима – повышение скорости в трубках за счет увеличенной подачи питательной воды, как в опреснителях «Атлас», или за счет искусственной циркуляции, как в пластинчатых опреснителях «Нирекс» и «Лаваль». В этих конструкциях испаряемая вода проходит последовательно через ряд узких щелевых каналов между пластинами, причем суммарная длина этих каналов достигает 20 м. Очевидно, если в каналах будет допущено кипение, то ввиду большого объема пара водосодержание смеси будет слишком малым для надежного смачивания пластин. Не случайно фирма Нирекс была вынуждена с 1961 г. в своих пластинчатых опреснителях организовать адиабатное испарение с принудительной циркуляцией, а в малых моделях ради упрощения вместо этого увеличить коэффициент подачи до 5-6.
Естественная циркуляция, как в вертикально-трубных опреснителях серии Д, также в некоторой степени уменьшает паросодержание смеси, но приводит к некоторому усложнению конструкции батареи. Поэтому проще допустить повышенную подачу питательной воды.
Из других примеров влияния повышенного паросодержания можно упомянуть известные случаи интенсивного отложения накипи на верхних змеевиках испарителей с частичным погружением батарей. Усиленному отложению накипи здесь способствует также пена, в которой оболочки паровых пузырьков насыщены накипеобразователями.
Влиянию паросодержания смеси в наименьшей степени подвержены испарители с горизонтальными греющими трубками, которые омываются рассолом снаружи, в частности испарители «Эврика» (см. «Конструкции судовых опреснителей и характеристики опреснительных установокУтилизационные глубоковакуумные опреснители»). С этой же целью все фирмы рекомендуют эксплуатировать испарители при полном затоплении греющих батарей, несмотря на то, что в некоторых случаях частичное затопление позволяет достигнуть более интенсивной теплоотдачи.
Скорость движения рассола в испарителях с естественной циркуляцией невелика и не оказывает заметного влияния на темп и условия отложения накипи, если только не происходит усиленного упаривания внутри трубок. Как правило, она достаточна для создания равномерной концентрации рассола во всем водяном объеме испарителя и исключает возникновение застойных зон, где может быть усиленное отложение накипи вследствие задержки рассола. При искусственной циркуляции могут быть организованы достаточно высокие скорости – до 3 м/сек, при которых наблюдается смывание накипи с поверхности нагрева.
Однако ввиду больших затрат энергии на преодоление гидравлических сопротивлений циркуляционного тракта такие скорости практически нигде не допускаются. Другая причина, исключающая применение таких скоростей, – подавление кипения во входной части трубок вследствие повышенного напора.
Более умеренные скорости (около 1-2 м/сек) встречаются часто. Не подавляя кипения, они способствуют выравниванию концентраций рассола в пристенном слое и в межтрубных промежутках, уменьшая таким образом пересыщение в пристенном слое.
Особенно заметен эффект повышенной скорости рассола в вакуумных и глубоковакуумных испарителях, где она способствует уменьшению весового паросодержания смеси и, следовательно, уменьшению количества отлагающейся накипи. Экспериментальное исследование влияния скорости циркуляции на отложение накипи внутри трубок проведено Бутчером.
Влияние многократной искусственной циркуляции на отложение накипи на трубках, омываемых рассолом снаружи, исследовалось И. Э. Апельциным и Халлиевым. Было отмечено значительное снижение количества накипи благодаря тому, что степень пересыщения воды на входе и выходе изменялась не столь резко, как без циркуляции. Действительно, если в последнем случае степень пересыщения испаряемой воды (количество избыточных накипеобразователей) составляет A, то при циркуляции с кратностью m степень пересыщения
Благодаря меньшему избытку солей отложение накипи идет медленнее, хотя в конечном счете время контакта рассола с поверхностями нагрева при этом не уменьшается. По-видимому, влияние времени значительно меньше, чем степени пересыщения.
В опытах с искусственной циркуляцией при m = 10 ÷ 12 достигалось уменьшение веса накипи в четыре-пять раз. Дополнительными факторами, способствующими столь заметному эффекту, являлись, по-видимому, отложение накипи на Расчет элементов систем трубопроводов на суднестенках трубопроводов и промежуточного сосуда, а также унос взвешенных частиц накипи из зоны кипения благодаря интенсивному движению рассола.
Однако неблагоприятные условия работы циркуляционного насоса и в большинстве случаев отсутствие возможности его размещения на судне не позволяют рассчитывать на сколько-нибудь широкое распространение искусственной циркуляции рассола как метода борьбы с накипью на судах.
Приведенные выше данные могут быть использованы для приближенного расчета скорости образования накипи и роста теплового сопротивления для кипящих испарителей с наружным омыванием трубок рассолом. Пример расчета приведен в пункте «Расчет термического сопротивления при накипеобразовании в испарителях морской воды» ниже.
Нагревание без кипения, как в адиабатных испарителях, существенно замедляет образование накипи вплоть до температур примерно 76-78 °С. Основной фактор, обусловливающий это замедление, – невозможность выделения свободной углекислоты в процессе нагрева, благодаря чему замедляется распад бикарбонатов. Отсутствие паровых пузырьков на поверхности нагрева затрудняет также образование накипи, так что весь процесс ее отложения сводится лишь к кристаллизации из пересыщенного пограничного диффузионного слоя. Есть, однако, и неблагоприятный фактор (недостаток больший, чем в кипящих испарителях) – перегрев пограничного слоя, что вызывает и большее его пересыщение. В проточных испарителях, кроме того, отрицательно сказывается и большой коэффициент подачи питательной воды.
Законченных исследований по сравнению накипеобразования в адиабатных и кипящих испарителях пока нет, да и выбор базы для сравнения затруднителен. В самом деле, трудно решить, с каким кипящим испарителем можно сравнивать адиабатный, где температура воды повышается от 28-30° до 75-78 °C. Какую температуру принять для сравнения в кипящем испарителе? Если 75-78 °C, то условия получаются несопоставимыми, так как конденсаторы всех ступеней охлаждаются более холодной водой, а данная температура достигается лишь в подогревателе. По-видимому, правомерно сопоставление их лишь с многоступенчатыми кипящими испарителями в том же диапазоне температур (либо одноступенчатого адиабатного с одноступенчатым кипящим испарителем).
Единственным достоверным подтверждением меньшего накипеобразования в подогревателях адиабатных испарителей даже с проточной схемой является опыт их эксплуатации на РТМ типа «Тропик» и «Атлантик», где при конечной температуре 55-60 °С срок работы подогревателя между чистками доведен до 4-5 тыс. ч, т. е. до года эксплуатации. Любой кипящий испаритель, работающий при этой температуре без противонакипных присадок, требует чистки гораздо раньше.
Перечисленные конструктивные и эксплуатационные факторы (за исключением паросодержания, которое в рассматриваемых подогревателях равно нулю) оказывают влияние на образование накипи в адиабатных испарителях в той же мере, что и в кипящих. Однако накопленные материалы еще недостаточны для расчета скорости накипеобразования.
Снижение температурного сопротивления накипи в испарителях морской воды
Проводятся исследования в направлении создания таких режимов работы испарителя, при которых отложения накипи были бы с возможно более высоким коэффициентом теплопроводности. Теплопроводная накипь заметно повышает устойчивость работы испарителя во времени и обеспечивает эффективную очистку его греющих батарей методом теплового удара.
Максимальная эффективность испарителей морской воды, работающих в условиях накипеобразования, достигается при оптимальной рабочей концентрации кипящего рассола, обеспечивающей наибольшую суммарную производительность испарителя за выбранный промежуток времени τ его работы без очистки.
Процесс частичного удаления накипи с элементов греющих батарей методом «холодного душа» сложен и сравнительно малоэффективен. Сейчас все более широкое применение получает новый метод частичной очистки греющих батарей от накипи, названный «холодным продуванием» и основанный также на явлении тепловых деформаций.
«Холодное продувание» производится без осушения корпуса испарителя от рассола и практически без вывода установки из действия. Покрытые накипью элементы греющей батареи находятся в кипящем рассоле. Греющий пар на батарею перекрывают и в ее внутреннюю полость (паровую) открывают доступ пресной воды с низкой температурой (например, от гидрофора мытьевой воды). В судовых условиях слив воды можно осуществлять непосредственно в танк пресной (мытьевой) воды, поэтому ее потери исключаются. Прокачка воды через батарею испарителя обычно производится в течение двух-трех минут до тех пор, пока ее температура на выходе из батареи не будет неизменной.
В результате однократного «холодного продувания» прямотрубной батареи при осушенном корпусе испарителя эффект ее очистки от накипи в три раза превышает эффект очистки способом «холодного душа» при одинаковых расходах охлаждающей морской воды.
Экспериментальное сравнение трехкратного «холодного душа» и трехкратного «холодного продувания» при заполненном горячим рассолом корпусе прямотрубного испарителя показало, что «холодное продувание» по сравнению с «холодным душем» дает в пять раз больший эффект очистки от накипи.
Интересные результаты дало многократное «холодное продувание», проводившееся через четыре часа в течение десяти суток работы испарителя ИВС-3К на режиме с постоянными рабочими параметрами и концентрацией рассола в корпусе 70 тыс. мг/л. Было проведено 50 трехминутных «продуваний» батареи испарителя пресной водой с температурой 12 °С и расходе 90 л/мин при заполненном горячим рассолом корпусе. Время, затраченное на отсечку пара, прокачку пресной воды и последующий вывод установки на режим, составляло 8-9 мин. Таким образом, за десять суток работы установка выводилась из действия всего на шесть-семь часов.
Сравнение среднечасовой производительности испарителя при многократном «холодном продувании» через каждые четыре часа в течение 10 суток работы со среднечасовой производительностью проводившегося ранее идентичного режима работы без многократного «холодного продувания» показал о увеличение производительности на 16 %.
Изменение K = f(τ) в данном режиме можно видеть на рис. 1, л. Освидетельствование батареи после режима с многократным «холодным продуванием» показало, что змеевики покрыты накипью только частично, причем накипь многослойная, хрупкая, небольшой толщины (не более 0,5 ÷ 0,6 мм), легко удаляемая при обстукивании змеевиков.
Взвешивание накипи, отпавшей в результате многократного «холодного продувания» и оставшейся на змеевиках, показало, что эффект очистки батареи, считая по просушенной накипи, составляет 38,8 %. Таким образом, частичная очистка элементов греющей батареи от накипи методом «холодного продувания» дает в несколько раз больший эффект по сравнению с «холодным душем», не требует вывода опреснительной установки из действия на длительное время, занимает меньше времени и труда.
Применение данного метода позволяет продлить время безостановочной работы судовой опреснительной установки с погруженными поверхностями нагрева, работающей в режиме накипеобразования.
Осуществление «холодного продувания» требует минимальных затрат на модернизацию испарителей. При соответствующей доработке этот метод может быть использован для различных типов иных теплообменных трубчатых аппаратов (например, судовых масляных холодильников), поверхность которых покрывается накипью.
Наука и техника располагают определенными средствами для борьбы с вредным влиянием накипеобразования. Применительно к судовым испарителям морской воды этими средствами являются:
- правильный выбор теплофизических условий работы испарителя, обусловливающих количество, состав и структуру образующейся накипи;
- время пребывания рассола в испарителе и т. д.
И. Э. Апельцин и В. А. Клячко предлагают следующую классификацию методов борьбы с накипеобразованием в испарителях:
- подкисление воды и применение антинакипинов;
- добавление зернистых присадок (затравок);
- контактная стабилизация;
- гидрофобное покрытие поверхности теплообмена;
- применение специальных конструкций испарителей с подвижными и самоочищающимися поверхностями теплообмена;
- магнитная, ультразвуковая и радиационная обработка питательной воды.
Для подробного ознакомления с химическими методами борьбы с накипеобразованием, рассмотрим кратко основы других методов.
Зернистые присадки. При введении в испаряемый рассол зернистых присадок (тонкодисперсных порошков) их частицы становятся центрами кристаллизации, в связи с чем удается отвлечь процесс накипеобразования от поверхности нагрева на взвешенные в растворе частицы (суммарная поверхность которых оказывается значительно больше всей поверхности нагрева), т. е. заменить процесс накипеобразования интенсивным шламовыделением. Необходимо, чтобы кристаллическая структура присадки была идентична с тем веществом, которое по данным теплофизическим условиям работы является основной накипеобразующей компонентой в испарителе.
При многоступенчатой испарительной установке следует для каждой ее ступени иметь свой изолированный контур рециркуляции присадки, по кристаллическому строению аналогичный выделяющейся накипи. Первоначальный химический состав присадки не имеет существенного значения. Ее частицы быстро покрываются накипью данного кристаллического строения, и далее этот центр кристаллизации действует как идентичная частица данной накипи.
Необходимая концентрация присадки 8-10 г/л. Интенсивное шламообразование требует повышенной продувки испарителей, так как в противном случае возможно явление вторичного накипеобразования, т. е. явление налипания на теплообменных поверхностях комочков шлама, ранее образованного в слое кипящего рассола. Таким образом, условия шламообразования и интенсивности вторичного накипеобразования тесно связаны с характером циркуляции рассола в испарителе, локальным распределением его температуры и концентрации, а также неравномерностью распределения частиц присадки в различных зонах кипящего рассола в испарителе.
Контактная стабилизация. Метод контактной стабилизации заключается в том, что испаряемый рассол непрерывно циркулирует между испарителем и фильтром, загруженным зернами известняка или другого аналогичного материала. Необходимо, чтобы время контакта рассола с массой, загруженной в фильтр, соответствовало скорости кристаллизации накипеобразующих веществ при данных теплофизических условиях работы испарительной установки. Циркуляционный расход рассола через контактный фильтр должен в шесть-десять раз превышать расход питательной воды.
Применение контактной стабилизации позволяет на 85-90 % снизить количество накипи, образующейся в испарителе морской воды при трехкратном ее упаривании, но оно возможно лишь при наличии достаточного пространства для Виды топливных фильтров и фильтрационных установок используемых на судовых дизеляхразмещения фильтра, габариты которого сопоставимы с габаритами испарителя.
Гидрофобное покрытие теплообменной поверхности. При нанесении гидрофобной пленки на теплообменную поверхность адгезия гидратированных ионов и микрокристаллов накипеобразующих соединений к теплообменной поверхности происходит замедленно вследствие отсутствия сил сцепления с ней.
Сглаживая бугорки шероховатости, являющиеся центрами кристаллизации накипи из рассола, Покрытия с повышенной гидрофобностью для защиты от обледенениягидрофобное покрытие не только способствует замедлению процесса накипеобразования, но и вызывает явление самоочищения теплообменной поверхности от накипи. Последнее можно объяснить тем, что образующаяся накипь слабо связана с теплообменной поверхностью, в связи с чем проникающая в поры и трещины накипи вода вблизи теплообменной поверхности вскипает, образующийся пар раскалывает накипь и отрывает ее от теплообменной поверхности.
В качестве гидрофобного покрытия используются различные кремнийорганические, фторопластиковые и Рекомендуемые системы судовых покрытийэпоксифенольные лаки. Наиболее стойки в условиях работы морских испарителей покрытия из бакелитового лака, обеспечивающие замедление процесса накипеобразования в несколько раз. При этом собственное термическое сопротивление бакелитового покрытия (толщиной 0,1 мм) весьма незначительно (примерно 10 % от общего его значения при чистых теплообменниках). Способствуя переходу от пленочной к капельной конденсации, гидрофобное покрытие заметно интенсифицирует теплоотдачу в конденсаторах судовых испарительных установок. При существующей технологии слой лака в испарителях более тысячи часов не удерживается.
Применение специальных конструкций испарителей для уменьшения накипеобразования. В судовых испарителях начали применять эластичные самоочищающиеся греющие элементы, накипь с которых скалывается при их деформации. Обычно эти элементы выполняют из монель-металла и применяют при небольших давлениях греющего пара, что обусловливает вакуумный режим работы испарителей, оборудованных подобными батареями.
Из эластичных батарей наиболее широко используются элементы:
- «термофлекс»,
- «вафлекс»,
- «максим».
В этих элементах благодаря их эластичности, а в некоторых (например, «вафлекс») и благодаря большой скорости движения циклично вскипающего рассола накипеобразование уменьшается. Однако ожидаемый эффект полного самоочищения от накипи практикой не подтвердился.
Опыт эксплуатации судов Черноморского морского пароходства показывает, что накипеобразование в испарителе «Максим» (танкер «Мир») оказывается даже больше, чем в обычных прямотрубных испарителях «Скам» (танкер «Джузеппе Гарибальди») или «Вир» (танкер «Дружба»).
К другим недостаткам эластичных элементов относится затрудненность механической очистки и ремонта и необходимость их замены при местном повреждении.
Выполнены конструкции испарителей с кипением во вращающемся потоке. Рабочий процесс в этих испарителях характеризуется образованием между греющей поверхностью и кипящим рассолом тонкой вращающейся пленки. Повышение скорости движения рассола относительно поверхности теплообмена значительно повышает теплоотдачу и уменьшает накипеобразование.
Предлагается к прочтению: Судовые водоопреснительные установки, виды и особенности эксплуатации
Магнитная, ультразвуковая и радиационная обработка питательной воды. Существо рассматриваемых методов безреагентной предварительной обработки опресняемой воды сводится к созданию в обрабатываемой морской воде искусственных центров кристаллизации (зародышей) и отвлечению, таким образом, процесса накипеобразования от поверхности нагрева на искусственные центры кристаллизации.
Магнитная обработка морской воды заключается в том, что ее перед поступлением в испаритель пропускают через аппарат, где при помощи постоянных магнитов или электромагнитов создается магнитное поле. Механизм магнитной обработки воды изучен еще недостаточно. Одни исследователи считают, что при прохождении морской воды через магнитное поле молекулы перегруппировываются. В результате ослабления электростатических сил взаимодействия между частицами и изменения структуры воды раствора происходит выпадение солей в виде шлама. Другие полагают, что внешнее магнитное поле оказывает влияние на внутренние электромагнитные поля, действующие в молекулах и атомах веществ, находящихся в растворе, и вызывает изменение физических свойств обрабатываемых жидкостей.
Вероятно, изменения в основном сводятся к нарушению структуры молекул самой воды и гидратных оболочек ионов. Эти нарушения структуры сольватов создают условия для образования ионных ассоциаций, образующих дополнительные центры кристаллизации. Если без магнитной обработки карбонат кальция образует накипь из кристаллов кальцита с удельным весом 2,6 ÷ 2,8, то после магнитной обработки образуются модифицированные кристаллы арагонита с удельным весом 2,9 : 3. В дальнейшем происходит перекристаллизация арагонита в кальцит и вследствие увеличения объема кристаллов разрыхление накипи, благодаря чему она легче отделяется от поверхности нагрева. Необходимое условие применения магнитной обработки – удаление образующегося шлама.
Магнитная обработка опресняемой воды применяется на некоторых судах. Однако эксплуатационные данные о результатах применения этого метода противоречивы. В целом метод требует дальнейших серьезных исследований.
Ультразвуковая обработка морской воды, по-видимому, способствует интенсивному образованию новых центров кристаллизации вследствие возрастания флуктуаций плотности испаряемой воды. Возможно, имеет место и диспергирующее действие ультразвука из-за явлений кавитации, в результате чего происходит раздробление содержащейся в воде взвеси и извлечение из ее пор микрокристаллов накипеобразователей. Благодаря увеличению количества образующихся центров кристаллизации накипеобразующие соединения отвлекаются от поверхности нагрева и образование шлама происходит в массе воды. Установлено, что ультразвук слабо влияет на линейную скорость кристаллизации и положительно на образование новых центров кристаллизации.
Ультразвук успешно применяется для предотвращения накипеобразования в Судовые котлы и котельные установкиогнетрубных котлах. Применительно к испарителям морской воды окончательные рекомендации еще не выработаны.
Радиационная обработка морской воды. Облучение, создаваемое препаратом бромистого радия, приводит к резкому возрастанию числа центров кристаллизации. Установлено, что число центров кристаллизации в облученных образцах по сравнению с необлученными увеличивается в зависимости от продолжительности облучения в четыре-восемь раз.
В условиях работы испарителей морской воды эффективность этого метода еще не проверена.
Расчет термического сопротивления при накипеобразовании в испарителях морской воды
Данные о закономерностях накипеобразования (см. пункты «Механизм процесса накипеобразования в испарителях морской воды» и «Количество накипи в различных условиях испарения морской воды» выше) позволяют создать методику учета изменяющихся в связи с накипеобразованием условий теплопередачи в испарителях.
Изменение общего термического сопротивления теплообменной поверхности со слоем накипи (R = R0 + Rн) во времени τ запишем в виде
где:
- – величина, постоянная при заданных условиях теплообмена в испарителе;
- A – характеристика интенсивности теплообмена;
- F – поверхность нагрева;
- ∆t – температурный напор.
В первом приближении можно считать, что при постоянной концентрации рассола B количество образующейся накипи прямо пропорционально количеству переданного тепла (тепловому потоку) q за время τ. Поэтому
Применительно к условиям работы испарителей морской воды
Интегрируя формулу 12, получим
Сложность определения характеристики интенсивности теплообмена A, изменяющейся во времени, ограничивает возможности использования формулы 13 при подсчетах оптимальных условий работы испарительных установок.
Условия теплообмена в испарителях морской воды, работающих при накипеобразовании на греющих поверхностях, постоянно изменяются. При стабильных параметрах греющего пара (p1, t1), постоянном давлении в корпусе испарителя (p2) и неизменной разности температур ∆t происходит снижение коэффициента теплопередачи K во времени τ работы установки, что приводит к уменьшению производительности W. Возникает необходимость создать методику учета в тепловых расчетах указанных изменений.
Основные величины, характеризующие тепловую работу испарителя морской воды:
- температурный напор ∆t;
- производительность испарительной установки W;
- термическое сопротивление теплопередаче R, определяемое условиями теплообмена и накипеобразования.
Расчетные уравнения для каждой из указанных величин выводятся на основании уравнения теплового баланса испарительной установки
где:
- Q – количество тепла, переданного за период τ работы испарителя, ккал;
- K – коэффициент теплопередачи, ккал/(м2 · ч · град);
- F – площадь греющей поверхности, м2;
- ∆t – разность температур (температурный напор), град;
- τ – продолжительность времени работы испарительной установки, ч;
- r – теплота парообразования, ккал/кг;
- G – количество дистиллята, выработанного за период работы τ, кг.
Разность температур выражается уравнением
где:
- R – общее термическое сопротивление теплопередаче, м2 · ч · град/ккал;
где:
- R0 – термическое сопротивление теплопередаче при чистых поверхностях нагрева, м2 · ч · град/ккал;
- Rн – переменное термическое сопротивление, создаваемое образующейся при работе испарителя накипью, м2 · ч · град/ккал.
Переменная часовая производительность испарительной установки (в кг)
Для выяснения характера изменения термического сопротивления, создаваемого накипью, приняты следующие допущения:
1 Весовое количество образующейся накипи Gн пропорционально количеству выработанного испарителем дистиллята G (в кг);
где:
- a – коэффициент пропорциональности.
2 Накипь располагается равномерно по всей поверхности нагрева слоем толщиной δн.
где:
- Vн – объем образовавшейся накипи, м3;
- γн – удельный вес накипи, кг/м3.
При этих допущениях термическое сопротивление Rн можно выразить уравнением
где:
- λ – теплопроводность образующейся накипи, ккал/(м·ч·град).
Обозначив
назовем эту величину коэффициентом накипеобразования.
При принятых допущениях ε определяется составом испаряемого рассола, теплофизическими условиями работы испарителя и не зависит от производительности установки W и времени ее работы τ.
Заменив в формуле 16 количество выработанного дистиллята G за период работы τ через часовую производительность
получим уравнение, выражающее переменное термическое сопротивление накипи,
Общее термическое сопротивление теплопередаче работающего испарителя морской воды выразится уравнением
На основании этого уравнения можно установить значение коэффициента теплопередачи испарителя в любой момент времени его работы
Из формулы 20 следует, что интенсивность снижения k зависит от численных значений коэффициента накипеобразования ε, переменной производительности испарителя W, продолжительности его работы τ, а также условий теплообмена при чистых поверхностях нагрева, определяемых термическим сопротивлением R0. Коэффициент накипеобразования ε определяет приращение термического сопротивления теплопередаче за счет влияния накипеобразования и характеризует физико-химические и термические свойства накипи
На основании большого числа экспериментальных исследований можно ставить вопрос об использовании в тепловых расчетах испарителей некоторых обобщенных средних значений (формула 21) коэффициентов накипеобразования, выраженных как функция концентрации рассола B (в %) в корпусе испарителя.
Если задать для конкретного режима работы испарителя морской воды усредненное в течение времени τ значение часовой производительности, то формула 20 запишется
где:
- εB – коэффициент накипеобразования при принятой концентрации рассола в корпусе испарителя B, %;
- G = Wсрτ – количество дистиллята, которое выработает испарительная установка за период работы τ.
Задаваясь значениями допустимого коэффициента теплопередачи Kдоп в конкретных условиях работы испарителя, можно определить количество дистиллята, которое должна выработать установка до момента очистки греющих батарей от накипи,
Рассмотренный метод расчета термического сопротивления накипи Предлагаемый метод определения теплопередачи по коэффициенту накипеобразования не учитывает всех реальных условий эксплуатации, при которых в разное время года и при плавании в различных районах мирового океана образование накипи неодинаково. Предлагаемый метод определения теплопередачи можно применять с учетом принятых допущений.x позволяет проводить уточненные проектные и поверочные тепловые расчеты испарителей морской воды, работающих в условиях интенсивного накипеобразования, а также нормировать периоды очистки греющих батарей испарительных установок механическим путем, либо методами «холодного душа» или «холодного продувания».
Приведенный выше метод расчета теплового сопротивления накипи, будучи основан на опытных данных, позволяет определить конечный результат совместного действия всех факторов, влияющих на темп образования накипи и ее структуру, т. е. в конечном счете – на ее тепловое сопротивление.
Между тем во многих практических случаях возникает необходимость учесть влияние основных определяющих факторов порознь, особенно при условиях, отличных от тех, в которых были получены приведенные выше опытные данные. Для этого предлагается метод определения фактического количества накипи в различных условиях, исходя из потенциального ее количества, который позволяет учесть все основные факторы, определяющие скорость образования накипи в наиболее распространенных кипящих испарителях.
Метод состоит в следующем. Зная растворимость карбоната кальция, или при температуре трубок более 80 °С гидроокиси магния, можно приближенно определить потенциальное количество накипи при любой кратности упаривания и любой температуре испарения. Установив на основе опытных и теоретических данных, какая часть потенциального количества накипи оседает на трубках, а также зная удельный вес накипи, можно найти и толщину слоя накипи δн. Зная коэффициент теплопроводности накипи λ, можно установить величину теплового сопротивления
и определить искомый коэффициент теплопередачи для трубок, покрытых накипью, из общего выражения
Потенциальное количество накипи можно определить по диаграмме Ланжелье (см. п. «Количество накипи в различных условиях испарения морской воды» выше). Результаты должны быть скорректированы по наиболее вероятной щелочности морской воды в заданном районе работы судна.
Напомним, что диаграмма Ланжелье справедлива для средней щелочности 2,45 мг·экв/л или 119,8 мг CaCO3/л. В наиболее влажных районах щелочность можно оценить по океанографическим данным. Для некоторых районов Хильер приводит следующие данные (по CaCO3):
- Северное море – 119 мг/л, pH = 7,7;
- Северо-западная Атлантика – 122 мг/л, pH = 8;
- Экваториальная Атлантика – 129-130 мг/л, pH = 8,2;
- Южная Атлантика – 115 мг/л, pH = 7,6.
Вероятность образования сульфатной накипи диаграммой Ланжелье не учитывается. Предполагается, что во всех случаях может быть обеспечена такая степень упаривания, которая позволит избежать отложения сульфатов. В случае необходимости потенциальное количество сульфатной накипи может быть определено по рис. 10.
Наиболее сложный вопрос рассматриваемой методики – определение степени осаждения потенциальной накипи v0, представляющей собой отношение веса накипи, действительно отложившейся на поверхностях нагрева и стенках корпуса, к весу потенциальной накипи. Проще всего величина v0 определяется, когда q → 0. Очевидно, в этом случае она должна быть равна единице при любой концентрации в интересующем диапазоне, поскольку время упаривания неопределенно длительно, а поверхность нагрева, на которой существуют центры кристаллизации, достаточно велика.
В действительности минимальный тепловой поток, при котором происходит пузырьковое кипение, составляет 5 000 ккал/(м2 · ч), а максимальное значение v0, соответствующее наибольшей степени распада бикарбонатов (по данным Пивера и Хильера), не превышает 0,7.
Наименьшее значение v0 достигается при тепловых потоках, близких к критическим, когда из общего механизма образования накипи полностью исключается кристаллизация пограничного слоя между центрами парообразования. При этом основная часть накипеобразователей остается в рассоле в виде суспензии, а также в форме нераспавшихся бикарбонатов.
В этих условиях v0 ≈ 0,1 ÷ 0,15. Промежуточные значения могут быть установлены по данным эксплуатации и натурных испытаний, в частности, по данным Хильера, которые для одной из серий опытов при q = 120-150 тыс. ккал/(м2 · ч) приведены в таблице 3 выше.
В соответствии с этим построен график приближенных значений в зависимости от q для различных кратностей упаривания (рис. 14).
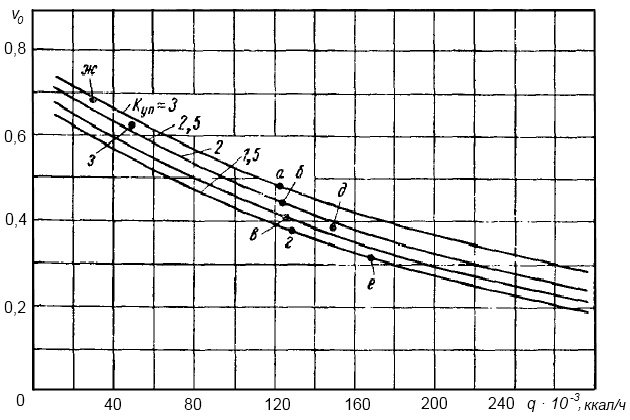
а, б, в, г – натурные испытания Хильера; д, е, ж – испытания испарителей ИВС-3, WY-6 и компрессорного; з – испытание испарителя ИЕР-7. p2 = 1,1 ÷ 1,3 кГ/см2
Все экспериментальные точки на этом графике получены в результате испытаний испарителей со змеевиковыми батареями, в которых время задержки рассола τ составляет 12-20 мин. При меньших значениях τ, характерных для прямотрубных батарей, степень распада бикарбонатов значительно меньше. В соответствии с этим уменьшается степень отложения накипи, так что ее приведенное значение получает вид
где:
- x – поправка на степень распада бикарбонатов.
Исходя из лабораторных определений скорости бикарбонатов (см. рис. 12), можно рекомендовать приближенную формулу
справедливую для 1 < τ < 15 мин
где:
- Vв – объем водяного пространства испарителя, л;
- m – коэффициент подачи питательной воды;
- W2 – производительность опреснителя, л/мин.
Вытеснение части воды паром в процессе испарения этой методикой не учитывается.
Менее точно, чем все предыдущие факторы, удается учесть то обстоятельство, что под действием вибрации и тепловых деформаций часть накипи отваливается с трубок. Величина коэффициента самоочищения μ может быть принята равной 0,75 ÷ 0,85 для змеевиковых и 0,65 ÷ 0,75 для прямотрубных горизонтальных батарей при температуре испарения более 45 °С. Верхние значения рекомендуемого диапазона справедливы при Kуп = 1,5, нижние – при Kуп = 2 и использовании холодного заполнения испарителя или холодного продувания трубок. Для глубоковакуумных испарителей (t2 < 45 °С), где карбонатная накипь отличается малой прочностью, μ = 0,55 ÷ 0,6. Для водотрубных испарителей, где накипь образуется на внутренней поверхности трубок, μ ≈ 0,95 ÷ 0,4.
По мере накопления опытных данных методика может быть уточнена. Однако и сейчас эти ориентировочные данные позволяют рассчитывать теплопередачу в различных условиях более обоснованно, чем при принятой до сих пор практике назначения полутора-двукратных запасов к величине поверхности, рассчитанной по коэффициенту теплопередачи для чистых трубок с неопределенным периодом работы между чистками. Что касается удельного веса накипи, то в обычных условиях он составляет:
- 1,6 ÷ 1,8 Г/см3 при q = 50-80 тыс. ккал/(м2 · ч);
- 2,3 ÷ 2,5 Г/см3 при q = 100-150 тыс. ккал/(м2 · ч).
Для иллюстрации предлагаемой методики приведем в качестве примера определение теплового сопротивления слоя накипи, образующегося в испарителе за 1 000 ч работы с температурой вторичного пара 50 °С при кратности упаривания Kуп = 1,5 и постоянной величине теплового потока q = 40 тыс. ккал/(м2 · ч). Постоянство теплового потока в испарителях с паровым обогревом достигается простейшим образом путем поддержания постоянного расхода греющего пара через дроссельную шайбу, перед которой неизменное давление p0 поддерживается магистральной автоматикой. При этом необходимо, чтобы p1 < 0,547 p0. Расчет произведем для Северной Атлантики, где щелочность можно принять равной Aм = 120 мг CaCO3/л, а pH = 7,7.
При удельном расходе тепла 640 ккал/кг заданной величине теплового потока соответствует удельный паросъем 62,5 кг/(м2 · ч).
Отсюда количество пара, приходящееся на 1 м2 поверхности нагрева за 1 000 ч,
По диаграмме Ланжелье растворимость CaCO3 в рассоле полуторной концентрации при pH = 7,7 и t2 = 50 °C составляет Aр = 65 мг/л. Отсюда количество потенциальной накипи на 1 кг дистиллята
Соответственно на 1 т дистиллята Gп = 230 г, а за период 1 000 ч на 1 м2
Степень отложения накипи, соответствующая заданному тепловому потоку (рис. 14), составляет 0,57. Приняв для рассматриваемого опреснителя прямотрубную батарею, находим по прототипу объем ее водяного пространства и по нему – время задержки рассола τ. Не приводя здесь расчета, укажем, что τ = 4 мин. Поправка на степень распада бикарбонатов
Приведенная степень отложения накипи
Отсюда количество накипи, отлагающейся на трубках и на необогреваемых поверхностях,
Вес накипи на трубках с учетом самоочищения и отложения на стенках
Удельный вес накипи γн = 1,65 Г/см3.
Объем накипи на 1 м2 поверхности трубок
Толщина слоя накипи
Коэффициент теплопроводности в соответствии с рис. 2 примем λн = 0,85 ккал/(м·ч·град). Тепловое сопротивление
Результаты расчета удовлетворительно совпадают с данными эксплуатации вакуумных испарителей с горизонтальными греющими трубками, что позволяет применять эту методику по крайней мере для сравнительных расчетов однотипных испарителей в различных условиях эксплуатации (при различных температурах, нагрузках и кратностях упаривания).
